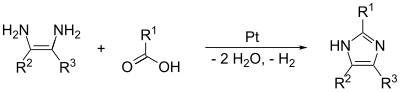Imidazol
| Imidazol | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Imidazol |
| Druga imena | 1,3-diazol glioksalin (arhajski) 1,3-diazaciklopenta-2,4-dien IUPAC ime: 1H-Imidazol |
| Molekularna formula | = C3H4N2 |
| CAS registarski broj | 288-32-4 |
| SMILES | c1cnc[nH]1 |
| InChI | 1/C3H4N2/c1-2-5-3-4-1/h1-3H,(H,4,5) |
| Kratki opis | Bijeli ili blijedo žuta čvrsta tvar |
| Osobine1 | |
| Molarna masa | 68.077 g/mol |
| Agregatno stanje | Čvrsto |
| Gustoća | 1.23 g/cm3, čvrst |
| Tačka topljenja | 89 do 91 |
| Tačka ključanja | 256 |
| Rastvorljivost | Rastvorljiv pKa = 14,5 (za imidazol) i 7, 05 (konjugatna kiselina) [1] |
| Dipolni moment | 3,61 D |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Imidazol je organski spoj sa formulom C3N2H4. To je bijela ili bezbojna čvrtsta tvar, koja je rastvorljiva u vodi, stvarajući blago alkalni rastvor. U hemiji, to je aromatski heterociklični spoj označen kao diazol, koji ima nesusjedne dušikove atome.
Mnogi prirodni proizvodi, a posebno alkaloidi, sadrže imidazolski prsten. Ovi imidazoli sadrže prsten 1,3-C3N2, ali su im svojstva promjenljiva, zavisno od supstituenta. Ovaj prstenski sistem je prisutan u važnim biološkim gradivnim blokovima, kao što su histidin i srodni hormon histamin. Mnogi lijekovi sadrže imidazolski prsten, kao što su neki antigljivični preparati, nitroimidazolski niz antibiotika i sedativ midazolam.[2][3][4][5][6] Kada je spojen na pirimidinski prsten stvara purin, koji se najčešće javlja kao dušični heterociklični spoj u prirodi.[7]
Struktura i svojstva
[uredi | uredi izvor]Imidazol je planarni 5-člani prsten. Postoji u dva ekvivalentna tautomerna oblika, jer pozitivni naboj se može nalaziti na bilo kojem od dva dušikova atoma. Imidazol je visoko polarni spoj, kao što se vidi po njegovom električnom dipolnom momentu od 3,67 D.[8] Vrlo je topiv u vodi. Ovaj spoj je označen kao aromatični zbog prisustva seksteta od π-elektrona, koji se sastoji od par elektrona iz protoniziraniH atoma dušika i jednog iz svakog od preostalih četiri atoma u prstenu. Neke rezonancne strukture imidazola su prikazane ispod:
Amfoterizam
[uredi | uredi izvor]Imidazol je amfoteran, što znači da može djelovati i kao kiselina i kao baza. Kao kiselina, pKa mui je 14,5 pri čemu stvara manje kiselosti nego karboksilne kiseline, fenoli i imidi, ali nešto više nego alkoholi. Proton kiselosti nalazi se na N-1. Kao baze, pKa konjugatne kiseline (pKBH+da bi se izbjegla zabuna između dvije) je oko 7, što čini imidazol oko šezdeset puta baznijim od piridina. Bazno mjesto je N3. Protonacija daje imidazoliumski kation, koji je simetričan.
Dobijanje
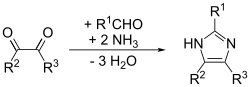
[uredi | uredi izvor]Imidazol je prvi put prikazan 1858. godine, iako su njegovi različiti derivati otkriveni još tokom 1840-ih. Njegova sinteza, kao što je prikazano u nastavku, koristi se gliokzalom i formaldehidom koji daju amonijak za stvaranje imidazola (ili glioksalina, kako je prvobitno nazvan).[9] Ova sinteza daje relativno mali prinos, ali se još primjenjuje za stvaranje imidazola sa zamijenjenim C.
U jednoj mikrotalasnoj promjeni, reaktanti su benzil, benzaldehid i amonijak u glacijalnoj sirćetnoj kiselini, stvarajući 2,4,5-triphenilimidazol (lofin).[10] Imidazol može biti sintetiziran brojnim metodima osim Debusovom metodom. Mnoge od ovih sinteza mogu se primijeniti sa različitim zamjenama imidazola i njegovih derivata variranjem funkcijske grupe reaktanata. Ove metode su obično kategorizirane na osnovu broja veza koje čine imidazolski prsten. Naprimjer, Debusov način stvaranja (1,2), (3,4), i (1,5) veza u imidazolu koristi svaki reagens kao fragment prstena i na taj način ova metoda bi billa sinteza putem stvaranja trostruke veze.
- Stvaranje jedne veze
- Veza (1,5) ili (3,4) može se stvarati reakcijom imidata i α-aminoaldehida ili α-aminoacetata, što dovodi do ciklizacije amidina u imidazol. Primjer koji slijedi primjenjuje se za imidazol kada je R = R1 = vodik.
- Stvaranje dvije veze
- Veze (1,2) i (2,3) stvaraju se tretiranjem 1,2-diaminoalkana na visokkim temperaturama, alkoholom, aldehidom ili karboksilnom kiselinom. Pritom je potreban katalizator, kao što je platina naaluminij-oksidu.
- Veze (1,2) i (3,4) mogu se također obrazovati od N-supstituiraniih α-aminoketona i formamida, uz zagrijavanje. Nastali proizvod je 1,4-disupstituirani imidazol, ali ovdje R = R1 = vodik, proizvod je imidazol. Prinos ove reakcije je umjeren, ali izgleda da je najefikasniji način izrade supstitucija na 1,4.
- Stvaranje četiri veze
Ovo je opći metod koji je u stanju da postigne dobre prinose za supstituciju imidazola. U suštini, to je prilagođavanje Debusovog metoda zvanog Debus-Radziszewski sinteza imidazola. Polazni materijali su supstituirani gliokzal, aldehid, amin i amonijak ili amonijeva so.[11]
- Stvaranje ostalih heterocikličnih veza
Imidazol se može sintetizirati u fotolizi 1 viniltetrazola. Ta reakcija će dati značajne prinose samo ako je 1-viniltetrazol uspješno napravljen iz organokositrenog spoja, kao što je 2-tributilstaniltetrazol. Putem niže prikazane reakcije proizvodi se imidazol kada R = R1 = R2 = vodik.
- Imidazol se može dobiti u reakciji isparavanja. Reakcija se događa s formamidom, etilendiaminom i vodikom, preko platine na aluminiju, što se mora odvijati između 340 i 480 °C. Ovako se dobija veoma čist imidazolski proizvod.
- Van Leusenova reakcija
- Za dobijanja imidazola također se može primijeniti Van Leusenova reakcija, polazeći od TosMIC i aldimina.
Biološki značaj i primjena
[uredi | uredi izvor]Imidazol je uključen u mnoge važne biološke molekule. Najviše je tu sveprisutne aminokiseline histidin, koja ima imidazolski bočni lanac. Histidin je prisutan u mnogim proteinima i enzimima i ima vitalnu ulogu u strukturi i ulozi vezanja hemoglobina. Spojevi na bazi imidazola imaju vrlo važnu ulogu u unutarćelijskim buferskim reakcijama.[12] Histidin može biti dekarboksiliran u histamin, koji je ujedno i opći biološki spoj. To može dovesti do urtikarija (koprivnjača), kada se histamin proizvodi u alergijskim reakcijama. Odnosi između histidina i histamina su prikazane ispod:
Jedna od primjena imidazola je prilikom prečišćavanja histidinom označenih proteina i afinitetnom hromatografijom imobiliziranih metala (IMAC). Imidazol se koristi za eluiranje označenih proteini vezanih za niklene ione vezane za površinu kapljice u hromatoglafskoj koloni. Višak imidazola koji je prošao kroz kolonu, potiskuje obilježeni histidin iz koordinacije nikla, oslobađajući njime obilježene proteine. Imidazol je postao važan dio mnogih farmaceutskih proizvoda. Sintetički imidazoli su prisutni u mnogim fungicidima i antigljivičnim, antiprotozoanskim i antihipertenzivnim lijekovima. Imidazol je dio molekula teofilina, nađenog u čaju i kahvi u zrnu, koji stimulira centralni nervni sistem. Prisutan je u antitumorskom lijeku merkaptopurinu protiv leukemije, tako što ometa aktivnosti DNK.[13]<
Jedan broj supstituiranih Imidazola, uključujući i hlotrimazol, su selektivni inhibitori sinteze dušik-oksida, što ih čini zanimljivim ciljevima pri izradi lijekova protiv upala, neurodegenerativnih bolesti i tumora nervnog sistrema.[14][15] Ostale biološke activnosti imidazolskih farmakofora vezave su podregulaciju tokova unutarćelijskog Ca2+ iK+ i interferencijom sa inicijacijom translacije.[16]
Farmaceutske izvedenice
[uredi | uredi izvor]Supstituirani derivati imidazola su vrijedni u liječenju mnogih sistemskih gljivičnih infekcija.[17] Imidazoli pripadaju klasi dušičnih antimikotika, što uključuje ketokonazol, mikonazol i klotrimazol.
Za usporedbu, još jedna grupa azola su riazoli, koji uključuju: flukonazol, itrakonazol i vorikonazol. Razlika između imidazola i triazola je u mehanizmu inhibicije P450 enzima. N3 imidazolski spojevi vežu se za hemski atom željeza u citohromu P450, a N4 triazoli se vežu za hemijsku grupu. Triazoli su pokazali da imaju veću specifičnost za P450 nego imidazoli, po čemu su potentniji nego imidazoli.[18]
Neke izvedenice imidazola pokazuju efekte na insektima. Naprimjer, sulkonazol nitrat pokazuje snažan antihranidbeni efekt na varenje keratina kod larvi australijske bube koja napada tepihe (Anthrenocerus australis), kao što to čini ekonazol-nitrat sa uobičajenim moljcem koji napada odjeću (Tineola bisselliella).[19]
Industrijska primjena
[uredi | uredi izvor]Imidazol se opsežno koristi kao inhibitor za određene tranzicijske metale, kao što je korozija bakra. Sprečavanje korozije bakra je važno, posebno u vodenom sistemima, gdje se provodljivost bakra smanjuje zbog korozije.
Mnogi spojevi industrijskog i tehnološkog značaja sadrže derivate imidazola. Termostabilni polibenzimidazol (PBI) sadrži imidazol spojen na benzenski prsten koji je povezan sa benzenom, a ponaša se kao sredstvo za gašenje vatre. Imidazoli se mogu naći u raznim spojevima koji se koriste za fotografiranju i elektrotehnici.
Soli imidazola
[uredi | uredi izvor]
Soli imidazola gdje je imidazolski prsten u kationu su poznati kao imidazolijske soli (naprimjer, imidazolij hlorid). Ove soli se stvaraju iz protonacija ili supstitucija na dušiku imidazola. Koriste se kao ionske tečnosti i prekursori u stabilnim karbenima. Soli gdje se nalazi deprotonirani imidazol anion su također poznate, kao imidazolati (naprimjer, natrij-imidazolat, NaC3H3N2).
Srodni heterociklični spojevi
[uredi | uredi izvor]- Benzimidazol, analog sa spojenim benzenskim prstenom;
- Dihidroimidazol ili imidazolin, analog gdje je zasićena 4,5-dvostruka veza;
- Pirol, analog sa samo jednim dušikovim atomom, na poziciji 1;
- Oksazol, analog sa dušikovim atomom koji je na poziciji 1 zamijenjen kisikom;
- Tiazol, analog sa dušikovim atomom koji je na poziciji 1 zamijenjen sumporom;
- Pirazol, analog sa dva susjedna dušikova atoma;
- Triazoli, analozi sa tri atoma dušika.
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Walba, H.; Isensee, R. W. (1961). "Acidity constants of some arylimidazoles and their cations". J. Org. Chem. 26 (8): 2789–2791. doi:10.1021/jo01066a039.
- ^ Karitzky, A. R.; Rees (1984). Comprehensive Heterocyclic Chemistry. 5. str. 469–498. CS1 održavanje: nepreporučeni parametar (link)
- ^ Grimmett, M. Ross (1997). Imidazole and Benzimidazole Synthesis. Academic Press.
- ^ Brown, E. G. (1998). Ring Nitrogen and Key Biomolecules. Kluwer Academic Press.
- ^ Pozharskii, A. F.; et al. (1997). Heterocycles in Life and Society. John Wiley & Sons.
- ^ Gilchrist, T. L. (1985). Heterocyclic Chemistry. Bath Press. ISBN 0-582-01421-2.
- ^ Rosemeyer, H. (2004). "The Chemodiversity of Purine as a Constituent of Natural Products". Chemistry & Biodiversity. 1 (3): 361. doi:10.1002/cbdv.200490033.
- ^ Christen, Dines; Griffiths, John H.; Sheridan, John (1981). "The Microwave Spectrum of Imidazole; Complete Structure and the Electron Distribution from Nuclear Quadrupole Coupling Tensors and Dipole Moment Orientation". Zeitschrift für Naturforschung A. 36 (12): 1378–1385. Bibcode:1981ZNatA..36.1378C. doi:10.1515/zna-1981-1220.
- ^ Debus, Heinrich (1858). "Ueber die Einwirkung des Ammoniaks auf Glyoxal" [On the reaction of ammonia upon glyoxal]. Annalen der Chemie und Pharmacie. 107 (2): 199–208. doi:10.1002/jlac.18581070209.
- ^ Crouch, R. David; Howard, Jessica L.; Zile, Jennifer L.; Barker, Kathryn H. (2006). "Microwave-Mediated Synthesis of Lophine: Developing a Mechanism To Explain a Product". J. Chem. Educ. 83 (11): 1658. doi:10.1021/ed083p1658.
- ^ US patent reference|number=6,177,575|year=2001|m=01|d=23|author=Arduengo, A. J.|title=Process for Manufacture of Imidazoles.
- ^ Hochachka, P. W.; Somero, G. N. (2002). Biochemical Adaptation: Mechanisms and Process in Physiological Evolution. New York: Oxford University Press.
- ^ Alberts B.; et al. (2002). Molecular Biology of the Cell, 4th Ed. Garland Science. ISBN 0-8153-4072-9. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Castaño, T.; Encinas, A.; Pérez, C.; Castro, A.; Campillo, N. E.; Gil, C. (2008). "Design, synthesis, and evaluation of potential inhibitors of nitric oxide synthase". Bioorg. Med. Chem. 16 (11): 6193–6206. doi:10.1016/j.bmc.2008.04.036. PMID 18477512.
- ^ Bogle, R. G.; Whitley, G. S.; Soo, S. C.; Johnstone, A. P.; Vallance, P. (1994). "Effect of anti-fungal imidazoles on mRNA levels and enzyme activity of inducible nitric oxide synthase". Br. J. Pharmacol. 111 (4): 1257–1261. doi:10.1111/j.1476-5381.1994.tb14881.x. PMC 1910171. PMID 7518297.
- ^ Khalid, M. H.; Tokunaga, Y.; Caputy, A. J.; Walters, E. (2005). "Inhibition of tumor growth and prolonged survival of rats with intracranial gliomas following administration of clotrimazole". J. Neurosurg. 103 (1): 79–86. doi:10.3171/jns.2005.103.1.0079. PMID 16121977.
- ^ Leon Shargel. Comprehensive Pharmacy Review (6th izd.). str. 930.
- ^ Riviere and Papich. Veterinary Pharmacology and Therapeutics (9th izd.). str. 1019–1020.
- ^ Sunderland, M. R.; Cruickshank, R. H.; Leighs, S. J. (2014). "The efficacy of antifungal azole and antiprotozoal compounds in protection of wool from keratin-digesting insect larvae". Textile Res. J. 84 (9): 924–931. doi:10.1177/0040517513515312.