Alfa-2-Makroglobulin
α2-Makroglobulin (α-2-M) ili alfa-2-makroglobulin, je veliki (720 KDa) plazmatski protein koji se nalazi u krvi. Uglavnom ga proizvodi jetra, a također ga lokalno sintetiziraju makrofagi, fibroblasti i adrenokorteksne ćelije. Kod ljudi je kodiran genom "A2M".
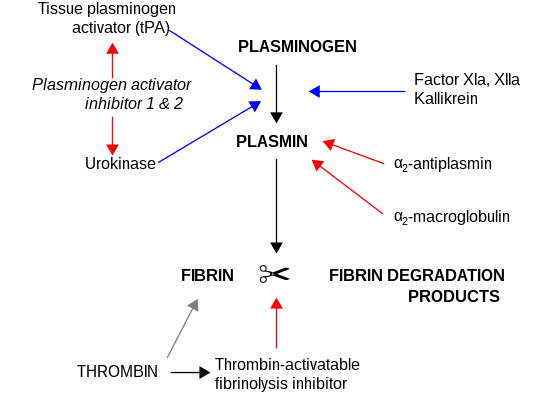
α2-Makroglobulin djeluje kao antiproteaza i može inaktivirati ogroman broj proteinaza. Djeluje kao inhibitor fibrinolize inhibirajući plazmin i kalikrein. Djeluje kao inhibitor koagulacije, inhibiranjem trombina. α2-Makroglobulin može djelovati kao protein nosač jer se također vezuje za brojne faktore rasta i citokine, kao što su trombocitni faktor rasta, osnovni faktor rasta fibroblasta, TGF-β, insulin i IL- 1β.
Nije prepoznat nikakav specifičan nedostatak s pridruženom bolešću i nijedno bolesno stanje se ne pripisuje niskim koncentracijama α2-makroglobulina. Koncentracija α2-makroglobulina raste 10 puta ili više u nefrotskom sindromu, kada se drugi proteini niže molekulske težine izgube u urinu. Gubitak α2-makroglobulina u urinu spriječen je njegovom veličinom. Neto rezultat je da α2-makroglobulin dostiže nivoe u serumu jednake ili veće od onih albumina u nefrotskom sindromu, što ima efekt održavanja onkotskog pritiska.
Struktura
[uredi | uredi izvor]Ljudski α2-makroglobulin sastoji se od četiri identične podjedinice povezane zajedno -S-S-vezama.[5][6] Pored tetramernih oblika α2-makroglobulina, identifikovan je i dimerni, a nedavno i monomerni inhibitor αM proteaze.[7][8]
Svaki monomer kjudskog α2-makroglobulina sastoji se od nekoliko funkcionalnih domena, uključujući domene makroglobulina, domen koji sadrži tiolni ester i domen koji se vezuje za receptor.[9] Sve u svemu, α2-makroglobulin je najveći glavni neimunoglobulinski protein u ljudskoj plazmi.
Pokazalo se da je aminokiselinska sekvenca α2-makroglobulina 71% ista kao protein zone trudnoće (PZP; također poznat kao α povezan s trudnoćom 2-glikoprotein).[10]
Aminokiselinska sekvenca
[uredi | uredi izvor]Dužina polipeptidnog lanca je 1.474 aminokiseline, a molekulska težina 163.291 Da.[5]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MGKNKLLHPS | LVLLLLVLLP | TDASVSGKPQ | YMVLVPSLLH | TETTEKGCVL | ||||
| LSYLNETVTV | SASLESVRGN | RSLFTDLEAE | NDVLHCVAFA | VPKSSSNEEV | ||||
| MFLTVQVKGP | TQEFKKRTTV | MVKNEDSLVF | VQTDKSIYKP | GQTVKFRVVS | ||||
| MDENFHPLNE | LIPLVYIQDP | KGNRIAQWQS | FQLEGGLKQF | SFPLSSEPFQ | ||||
| GSYKVVVQKK | SGGRTEHPFT | VEEFVLPKFE | VQVTVPKIIT | ILEEEMNVSV | ||||
| CGLYTYGKPV | PGHVTVSICR | KYSDASDCHG | EDSQAFCEKF | SGQLNSHGCF | ||||
| YQQVKTKVFQ | LKRKEYEMKL | HTEAQIQEEG | TVVELTGRQS | SEITRTITKL | ||||
| SFVKVDSHFR | QGIPFFGQVR | LVDGKGVPIP | NKVIFIRGNE | ANYYSNATTD | ||||
| EHGLVQFSIN | TTNVMGTSLT | VRVNYKDRSP | CYGYQWVSEE | HEEAHHTAYL | ||||
| VFSPSKSFVH | LEPMSHELPC | GHTQTVQAHY | ILNGGTLLGL | KKLSFYYLIM | ||||
| AKGGIVRTGT | HGLLVKQEDM | KGHFSISIPV | KSDIAPVARL | LIYAVLPTGD | ||||
| VIGDSAKYDV | ENCLANKVDL | SFSPSQSLPA | SHAHLRVTAA | PQSVCALRAV | ||||
| DQSVLLMKPD | AELSASSVYN | LLPEKDLTGF | PGPLNDQDNE | DCINRHNVYI | ||||
| NGITYTPVSS | TNEKDMYSFL | EDMGLKAFTN | SKIRKPKMCP | QLQQYEMHGP | ||||
| EGLRVGFYES | DVMGRGHARL | VHVEEPHTET | VRKYFPETWI | WDLVVVNSAG | ||||
| VAEVGVTVPD | TITEWKAGAF | CLSEDAGLGI | SSTASLRAFQ | PFFVELTMPY | ||||
| SVIRGEAFTL | KATVLNYLPK | CIRVSVQLEA | SPAFLAVPVE | KEQAPHCICA | ||||
| NGRQTVSWAV | TPKSLGNVNF | TVSAEALESQ | ELCGTEVPSV | PEHGRKDTVI | ||||
| KPLLVEPEGL | EKETTFNSLL | CPSGGEVSEE | LSLKLPPNVV | EESARASVSV | ||||
| LGDILGSAMQ | NTQNLLQMPY | GCGEQNMVLF | APNIYVLDYL | NETQQLTPEI | ||||
| KSKAIGYLNT | GYQRQLNYKH | YDGSYSTFGE | RYGRNQGNTW | LTAFVLKTFA | ||||
| QARAYIFIDE | AHITQALIWL | SQRQKDNGCF | RSSGSLLNNA | IKGGVEDEVT | ||||
| LSAYITIALL | EIPLTVTHPV | VRNALFCLES | AWKTAQEGDH | GSHVYTKALL | ||||
| AYAFALAGNQ | DKRKEVLKSL | NEEAVKKDNS | VHWERPQKPK | APVGHFYEPQ | ||||
| APSAEVEMTS | YVLLAYLTAQ | PAPTSEDLTS | ATNIVKWITK | QQNAQGGFSS | ||||
| TQDTVVALHA | LSKYGAATFT | RTGKAAQVTI | QSSGTFSSKF | QVDNNNRLLL | ||||
| QQVSLPELPG | EYSMKVTGEG | CVYLQTSLKY | NILPEKEEFP | FALGVQTLPQ | ||||
| TCDEPKAHTS | FQISLSVSYT | GSRSASNMAI | VDVKMVSGFI | PLKPTVKMLE | ||||
| RSNHVSRTEV | SSNHVLIYLD | KVSNQTLSLF | FTVLQDVPVR | DLKPAIVKVY | ||||
| DYYETDEFAI | AEYNAPCSKD | LGNA |
Funkcija
[uredi | uredi izvor]Proteinska porodica α-makroglobulin (αM) uključuje inhibitor proteaza,[11] tipiziran ljudski tetramerni α2-makroglobulin (α2M); pripadaju porodici inhibitora MEROPS proteinaza I39, klan IL. Ovi inhibitori proteaze dijele nekoliko definirajućih svojstava, koja uključuju
- (1) sposobnost da inhibiraju proteaze iz svih katalitskih klasa,
- (2) prisustvo 'regije mamaca' (takođe poznat kao sekvenca aminokiselina u α2-makroglobulinskoj molekuli, ili homolognom proteinu, koji sadrži cisilne peptidne veze za one proteinaze koje inhibira) i tiol estar,
- (3) sličan mehanizam inhibicije proteaze i
- (4) inaktivacija inhibitornog kapaciteta reakcijom tiolskog estera sa malim primarnim aminima. αM inhibitor proteaze inhibira sternim preprekama.[12] Mehanizam uključuje proteazno cijepanje regije mamaca, segmenta αM koji je posebno osjetljiv na proteolitsko cijepanje, što pokreće konformacijsku promjenu, tako da se αM kolabira oko proteaze. U rezultirajućem kompleksu αM-proteaze, aktivno mjesto proteaze je sterno zaštićeno, čime se značajno smanjuje pristup proteinskim supstratima. Dva dodatna događaja se javljaju kao posljedica cijepanja regije mamaca, naime (1) h-cisteinil-g-glutamil tiol ester postaje visoko reaktivan i (2) velika konformacijska promjena otkriva konzervirani COOH-terminalni receptor vezujući domen[13] (RBD). Izlaganje RBD-u omogućava αM proteazi kompleks da veže da očisti receptore i da bude uklonjena iz cirkulacije.[14] Identificirani su tetramerni, dimerni i nedavno monomerni inhibitori αM proteaze.[7][8]
α2-Makroglobulin je u stanju da inaktivira ogroman broj proteinaza (uključujući serinska–, cisteinaka–, asparaginska– i metaloproteinaza). Djeluje kao inhibitor fibrinoliza inhibicijom plazmina i kalikreina. Djeluje kao inhibitor koagulacije, inhibiranjem trombina.[15] α2-Makroglobulin u svojoj strukturi ima regiju "mamca" od 35 aminokiselina. Proteinaze koje vezuju i cijepaju regiju mamaca postaju vezane za α2M. Makrofagni receptori prepoznaju kompleks proteinaza–α2M i uklanjaju ga iz sistema.
Poznato je da α2-Makroglobulin veže cink, kao i bakar u plazmi, čak i jače od albumina, a poznat je i kao transkuprein.[16] 10 to 15% of copper in human plasma is chelated by α2-macroglobulin.[17]
Bolest
[uredi | uredi izvor]α2-Nivo makroglobulina se povećava kada su nivoi albumina u serumu niski,[18] što se najčešće viđa kod nefrotskog sindroma, stanja u kojem bubrezi počinju da ispuštaju neke od manjih krvnih proteina. Zbog svoje veličine, α2-makroglobulin se zadržava u krvotoku. Povećana proizvodnja svih proteina znači povećanje koncentracije α2-makroglobulina. Ovo povećanje ima mali negativan uticaj na zdravlje, ali se koristi kao dijagnostički trag.
Uobičajena varijanta (29,5%) (polimorfizam) α2-makroglobulina dovodi do povećanog rizika od Alzheimerove bolesti.[19][20]
α2-Makroglobulin vezuje se za i uklanja aktivne oblike želatinaza (MMP-2 i MMP-9) iz cirkulacije preko receptora za čišćenje na fagocitima.
Reference
[uredi | uredi izvor]- ^ a b c GRCh38: Ensembl release 89: ENSG00000175899 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000030111 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Andersen GR, Koch TJ, Dolmer K, Sottrup-Jensen L, Nyborg J (oktobar 1995). "Low resolution X-ray structure of human methylamine-treated alpha 2-macroglobulin". J. Biol. Chem. 270 (42): 25133–41. doi:10.1074/jbc.270.42.25133. PMID 7559647. S2CID 86387917.
- ^ Sottrup-Jensen L, Stepanik TM, Kristensen T, Wierzbicki DM, Jones CM, Lønblad PB, et al. (1984). "Primary structure of human alpha 2-macroglobulin. V. The complete structure". J Biol Chem. 259 (13): 8318–27. doi:10.1016/S0021-9258(17)39730-2. PMID 6203908.
- ^ a b Dodds AW, Law SK (decembar 1998). "The phylogeny and evolution of the thioester bond-containing proteins C3, C4 and alpha 2-macroglobulin". Immunol. Rev. 166: 15–26. doi:10.1111/j.1600-065X.1998.tb01249.x. PMID 9914899. S2CID 84262599.
- ^ a b Armstrong PB, Quigley JP (1999). "Alpha2-macroglobulin: an evolutionarily conserved arm of the innate immune system". Dev. Comp. Immunol. 23 (4–5): 375–90. doi:10.1016/s0145-305x(99)00018-x. PMID 10426429.
- ^ Doan N, Gettins PG (2007). "Human alpha2-macroglobulin is composed of multiple domains, as predicted by homology with complement component C3". Biochem J. 407 (1): 23–30. doi:10.1042/BJ20070764. PMC 2267405. PMID 17608619.
- ^ Devriendt K, Van den Berghe H, Cassiman JJ, Marynen P (1991). "Primary structure of pregnancy zone protein. Molecular cloning of a full-length PZP cDNA clone by the polymerase chain reaction". Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1088 (1): 95–103. doi:10.1016/0167-4781(91)90157-h. PMID 1989698.
- ^ Sottrup-Jensen L (juli 1989). "Alpha-macroglobulins: structure, shape, and mechanism of proteinase complex formation". J. Biol. Chem. 264 (20): 11539–42. doi:10.1016/S0021-9258(18)80094-1. PMID 2473064.
- ^ Enghild JJ, Salvesen G, Thøgersen IB, Pizzo SV (juli 1989). "Proteinase binding and inhibition by the monomeric alpha-macroglobulin rat alpha 1-inhibitor-3". J. Biol. Chem. 264 (19): 11428–35. doi:10.1016/S0021-9258(18)60482-X. PMID 2472396.
- ^ Enghild JJ, Thøgersen IB, Roche PA, Pizzo SV (februar 1989). "A conserved region in alpha-macroglobulins participates in binding to the mammalian alpha-macroglobulin receptor". Biochemistry. 28 (3): 1406–12. doi:10.1021/bi00429a069. PMID 2469470.
- ^ Van Leuven F, Cassiman JJ, Van den Berghe H (decembar 1986). "Human pregnancy zone protein and alpha 2-macroglobulin. High-affinity binding of complexes to the same receptor on fibroblasts and characterization by monoclonal antibodies". J. Biol. Chem. 261 (35): 16622–5. doi:10.1016/S0021-9258(18)66612-8. PMID 2430968.
- ^ de Boer JP, Creasey AA, Chang A, Abbink JJ, Roem D, Eerenberg AJ, Hack CE, Taylor FB (decembar 1993). "Alpha-2-macroglobulin functions as an inhibitor of fibrinolytic, clotting, and neutrophilic proteinases in sepsis: studies using a baboon model". Infect. Immun. 61 (12): 5035–43. doi:10.1128/iai.61.12.5035-5043.1993. PMC 281280. PMID 7693593.
- ^ Liu, Nanmei; Lo, Louis Shi-li; Askary, S. Hassan; Jones, LaTrice; Kidane, Theodros Z.; Nguyen, Trisha Trang Minh; Goforth, Jeremy; Chu, Yu-Hsiang; Vivas, Esther; Tsai, Monta; Westbrook, Terence; Linder, Maria C. (septembar 2007). "Transcuprein is a macroglobulin regulated by copper and iron availability". The Journal of Nutritional Biochemistry. 18 (9): 597–608. doi:10.1016/j.jnutbio.2006.11.005. PMC 4286573. PMID 17363239.
- ^ Liu, Nan-mei; Nguyen, Trang; Kidane, Theodros; Moriya, Mizue; Goforth, Jeremy; Chu, Andy; Linder, Maria (6. 3. 2006). "Transcupreins are serum copper-transporters of the macroglobulin family, and may be regulated by iron and copper". The FASEB Journal (jezik: engleski). 20 (4): A553–A554. doi:10.1096/fasebj.20.4.A553-d. ISSN 0892-6638.
- ^ Stevenson, FT; Greene, S; Kaysen, GA (januar 1998). "Serum alpha 2-macroglobulin and alpha 1-inhibitor 3 concentrations are increased in hypoalbuminemia by post-transcriptional mechanisms". Kidney International. 53 (1): 67–75. doi:10.1046/j.1523-1755.1998.00734.x. PMID 9453001.
- ^ Blacker D, Wilcox MA, Laird NM, Rodes L, Horvath SM, Go RC, Perry R, Watson B, Bassett SS, McInnis MG, Albert MS, Hyman BT, Tanzi RE (august 1998). "Alpha-2 macroglobulin is genetically associated with Alzheimer disease". Nat. Genet. 19 (4): 357–60. doi:10.1038/1243. PMID 9697696. S2CID 15628847.
- ^ Kovacs DM (juli 2000). "alpha2-macroglobulin in late-onset Alzheimer's disease". Exp. Gerontol. 35 (4): 473–9. doi:10.1016/S0531-5565(00)00113-3. PMID 10959035. S2CID 54409507.
- McPherson & Pincus: Henry's Clinical Diagnosis and Management by Laboratory Methods, 21st ed.
- Firestein: Kelley's Textbook of Rheumatology, 8th edition.
Vanjski linkovi
[uredi | uredi izvor]- MEROPS online baza podataka za peptidaze i njihove inhibitore: I39.001[mrtav link]
- alpha 2-Macroglobulin na US National Library of Medicine Medical Subject Headings (MeSH)
- A2M lokacija ljudskog genoma UCSC Genome Browser.
A2M detalji ljudskog genoma u UCSC Genome Browser.




