Glikoliza

Glikoliza (grč. γλυκύς - glykys = slatko + λύσις - lysis = razgradnja) – od srarog termina glikoza,[1] za glukozu – je metabolitski put koji pretvara glukozu C6H12O6 u piruvat, CH3COCOO− + H+. Slobodna energija koja se u tom procesu oslobađa, koristi se za formiranje visoko-energetskih spojeva ATP (adenozin trifosfata) i NADH. Glikoliza se odvija u nizu od deset sukcesivnih enzimski – kataliziranih reakcija. U tom slijedu, svaki prelazni oblik otvara ulaz u narednu fazu procesa glikolize. Naprimjer, većina monosaharida, kao što su fruktoza i galaktoza, može se pretvoriti ili uključiti u jedan od ovih međuprodukata. Prelazni oblici mogu također biti direktno iskorišteni, kao što je, primjerice, srednji dihidroksiaceton fosfat (DHAP) izvor glicerola koji se, pri formiranju masti, kombinira sa masnim kiselinama.[2]
Glikoliza je, dakle, centralni anaerobni metabolički proces, u kojem se glukoza (C6H12O6) putem desetak enzimskih reakcija razgrađuje u dvije molekule piruvata (C3H3O2). U mišićima eukariota, mnogim bakterijama i nekim gljivama taj proces se nastavlja sve do mliječne kiseline, a kod nekih kvasaca, u procesu alkoholnog vrenja, do etilalkohola i CO2. Glikoliza se odvija u citoplazmi, a nastali produkti se dalje aerobno razgrađuju u mitohondrijama.
Glikoliza je sveprisutni biohemijski proce jer se odvija kod životinja, biljaka, gljiva i većine bakterija. Tokom ovog procesa, dio oslobođene energije se skladišti u obliku adenozin trifosfata (ATP) za anaboličke reakcije. Glavni koraci u glikolizi su, kako slijedi.
Glukoza
- ↓
Glukoza-6-fosfat
- ↓
Fruktoza-6-fosfat
- ↓
Fruktoza-1,6-bisfosfat
- ↓
Gliceraldehid-3-fosfat←dihidroksiaceton-fosfat
- ↓
1,3-Bisfofoglicerat
- ↓*
3-Fosfoglicerat
- ↓
2-fosfoglicerat
- ↓
Fosfoenolpiruvat
- ↓*
Piruvat
- (*) Koraci u kojima se odvija fosforilacija ADP u ATP..[3]
Glikoliza je metabolički put koji je nezavisan od kisika, što znači da ne koristi molekulski kisik (tj. atmosferski) za bilo koju od uključenih reakcija. Međutim, proizvodi glikolize (piruvat i NADH + H+) su prisutni u post-glikoliznim procesima.
Kada se koristi molekulski kisik, proces se obično naziva aerobno disanje, a bez njega, za takav proces se kaže da je anaerobno disanje. Glikoliza se , dakle, s varijacijama,javlja u gotovo svim organizmima, u oba vida ćelijskog disanja: aerobnom i anaerobnom. Široka pojava glikolize u živom svijetu ukazuje na to da je to jedan od evolucijski najstarijih metabolizama. Zapravo, reakcije koje su uključene u glikolizu i paralelne puteve pentoza fosfata, javljaju se kao metal-katalizirane pod anaerobnim (bez kisika) uvjetima , kao što i u arhajskim okeanima. U nedostatku enzima, glikoliza se u početku mogla podsticati iz ograničenih hemijskih prebiotika.[4][5][6]
Glikoliza se javlja u većini organizama u ćelijskom citosolu. Najčešći tip glikolize je Embden-Meyerhof-Parnas (EMP) put, koji su otkrili Gustav Embden, Otto Meyerhof i Jakub Karol Parnas. Glikoliza se odnosi i na druge puteve, kao što su Entner-Doudoroff put, razne heterofermentacijske i homofermentacijske varijante.
Prema EMP putu , cijeli tok glikolize se možese podijeliti u dvije faze:[7]
- Pripremna faza u kojoj se ATP konzumira, po čemu je poznata i kao Faza investicije;
- Faza naplate u kojoj se proizvodi ATP.
Pregled[uredi | uredi izvor]
Sveukupni tok glikolize je kako slijedi.
| D-Glukoza | Piruvat | ||||
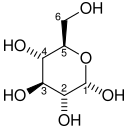
|
+ 2 [NAD]+ + 2[ADP] + 2[P]i | 
|
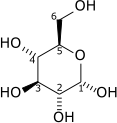
2 | 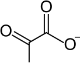
|
+ 2NADH + 2H+ + 2ATP + 2 H2O |
| Metabolizam običnih monosaharida, uključujući glikolizu i glukoneogenezu |
|---|
 |
Kao polazni tnaterijal u procesu disanja, polisaharidi se mogu se koristiti tek nakon prethodne razgradnje na prostije šećere. Tako se skrob u tkivima za nagmnilavanje energetskih rezervi najprije razlaže do prostih šećera, u ptisustvu vode i enzima amilaze: skrob + n H2O → amilaza + n glukoza.
U drugim tkivima, gdje se skrob nalazi samo privreremeno, njegova hidroliza se odvija pomoću enzima fosforilaze:
skrob + n H3P04 → fosforilaza + n glukozo-1-fosfat.
Toplotna energija koja se oslobađa u razgradnji skroba putem fosforilacije ostaje vezana u fosfat-estarskoj vezi glukoza-1-fosfata. Da bi se taj spoj mogao uključiti u glikolizu, mora se prethodno pretvoriti u pirogrožđanu kiselinu.[3]
Nastala pirogrožđana kiselina u anaerobnitn uvjetima, pri fementaciji, podvrgava se alkoholnom ili mliječnom vrenju, a u aerobnim uvjetima, nakon aktivacije ulazi u tzv. Krebsov ciklus. U mladim tkivima biljaka glukoza se pretežno razgrađuje u procesu glikolize. Sa starenjem tkiva, postepeno se povećava razgradnja glukoze, putem njene direktne oksidacije.
Glikoliza se odvija u citoplazmi, pri cemu se glukoza (kao svi drugi ugljikohidrati koji čine supstrat disanja), razlaže do dvije molekule pirogrožđane kiseline. Proces glikolize obuhvata četiri etape:
- aktivacija heksoza sa 2 molekule ATP-a,
- prevođenje molekula heksoze u 2 molekule trioze,
- dehidriranje gliceraldehid-3-fosfata i njegovo povezivanje sa neorganskitn fosforom, i
- stvaranje pirogrožđane kiseline (pituvata).
Energetska dobit procesa fermentacije iznosi dva mola ATP-a po molu glukoze, što je vemna malo. Proizvodnja i akumulacija alkohola pri fermentaciji odvija se u anaerobnim uvjetima. Obično se ovaj proces odvija kod mikroorganizama kod kojih se energija osigurava na račun oksidacije i razgradnje organskih jedinjenja dtugih bića. Ovakvi mikroorganizmi jako su osjetljivi na kisik, te u njegovom ptisustvu odmah uginu.
Nasuprot prethodnim, postoje mikroorganizmi koji mogu egzistirati i u ptisustvu i u odsustvu kiseonika. Takav je slučaj sa kvascima.
Put izlučivanja[uredi | uredi izvor]
Godine 1860., Louis Pasteur je otkrio da su mikroorganizmi odgovorni za fermentaciju, a zatim je 1897., Eduard Buchner našao da ekstrakt pojedinih ćelija može izazvati fermentaciju. Godine 1905., Arthur Harden i William Young, zajedno sa Nickom Sheppardom utvrđuju da je za fermentaciju obavezno i prisustvo termoosetljivih frakcija (enzima) i termo-neosjetljivih subćelijskih citoplazmatskih frakcija male molekulske težine (ADP, ATP i NAD+. Pritom je potreban i drugi kofaktori) visoke molekulske težine. Detalji puta su određeni 1940. godine, uz veliki doprinos Otta Meyerhofa, a nekoliko godina kasnije LuisaLeroira. Najveći poteškoće u određivanju zamršenosti ove mreže javljaju se zbog vrlo kratkog životnog vijeka i niske stabilnosti koncentracije prelaznih oblika brzih glikolitskih reakcija.
Sekvenca reakcījâ[uredi | uredi izvor]
Pripremna faza[uredi | uredi izvor]
Prvih pet koraka smatraju se pripremnom (ili investicijskom) fazom, jer ona troši energiju za pretvaranje glukoze u dva trougljična šećerna fosfata.
Prvi korak u glikolizi je fosforilacija glukoze, uz katalizu porodice enzima pod nazivom heksozakinaze da se formira glukoza 6-fosfat (G6P). Ova reakcija troši ATP, ali djeluje na održavanje niske koncentracije glukoze, što podstiče stalni transport glukoze u ćeliju, kroz plazma membranu transportera. Osim toga, on blokira glukozu da iscuri, pošto ćeliji nedostaje transporter za G6P. To je značajno zato što sprečava slobodnu difuzijeu iz ćelije, zbog prirode naboja G6P. Glukoza može alternativno biti formirana iz fosforilize ili hidrolize unutarćelijskog škroba ili glikogena.
U životinja, jedan izoenzim heksozakinaze pod nazivom glukokinaza se također koristi u jetri, koja ima znatno niži afinitet za glukozu (Km u blizini normalne glikemije), a razlikuje se u regulatornim svojstvima. Različiti afiniteti i alternativne regulacije ovog enzima su odraz uloge jetre u održavanju razine šećera u krvi.
Enzimska reakcija

Enzim: Heksokinaza (HK)
(jedna od transferaza)
Sustrat: D-Glukoza (Glc)
Produkt: α-D-Glukozo-6-fosfat (G6P)
Reakcija: Napredujuća
Produkt: Adenozin trifosfat
Manji produkt: H+ + adenozin difosfat
G6P se zatim rearanžira u fruktozo-6-fosfat (F6P) pomoću glukozo fosfat izomeraze.
Fruktoza također, u ovom trenutku, može ući u glikolitski put do fosforilacije.
Promjena u strukturi je izomerizacija, u kojoj je G6P je pretvoren u F6P. Za nastavak procesa, neophodan je enzim fosfoheksozo izomeraza. U normalnim ćelijskim uvjetima, ova reakcija je slobodna i reverzibilnia. Međutim, često je progresijska, zbog niske koncentracije F6P, koji se stalno konzumira u svakom narednom koraku glikolize. Pod uvjetima visoke koncentracije F6P, ova reakcija se lahko odvija i u obrnutom smjeru. Taj fenomen se može objasniti na temelju Le Chatelierov principa. Izomerizacije je potrebno na keto šećeru, za stabilizaciju ugljika u četvrtoj reakciji (korak ispod).
↓
Enzimska reakcija
Enzim: Fosfoglukozo izomeraza (PGI) jedna od izomeraza
Supstrat: α-D-Glukozo 6-fosfat (G6P)
Produkt: β-D-Frutozo 6-fosfat (F6P)
Reakcija: Reverzibilna


Potrošnje energije drugog ATP u ovom koraku je opravdana na dva načina: glikolitiski proces (do ovog koraka) je sada nepovratan, a isporučena energija destabilizira molekule. Budući da je reakcija katalizirana enzimom fosfofruktokinaza 1 (PFK-1) sklapanje ATP (jedan energetski povoljan korak) je, u suštini, nepovratan, a drugi put se mora koristiti za obrnutu konverziju u toku glukoneogeneze. To čini da je ova reakcija ključna regulatorna tačka (vidi dolje). Ovo je ujedno i korak ograničavanja.
Osim toga, druga fosforilacija je potrebno kako bi se omogućilo formiranje dvije odgovorne skupine (a ne samo jedna) u kasnijem koraku glikolize, osiguravajući sprečavanje slobodne difuzije iz ćelije.
Istu reakciju može katalizirati PFP (pirofosfat-ovisna fosfofruktokinaza), (partnerstvo za mir ili PPI-PFK), koji se nalazi u većini biljaka, nekim bakterijaama, Archaeaima i protistima, ali ne i kod životinja. Ovaj enzim koristi pirofosfat (PPI) kao donator fosfata, umjesto ATP. To je reverzibilna reakcija, koja povećva fleksibilnost glikolitskih metabolizma.
↓
Enzimska reakcija
Enzim:Fosfofruktokinaza 1 (PFK-1) (jedna od transferaza)
Supstrat: β-D-Fruktozo 6-fosfat (F6P)
Produkt: β-D-Fruktozo 1,6-bisfosfat (F1,6BP)
Reakcija: Napredujuća
Naredni supstrat: ATP
Naredni produkt: H+ + ADP


Destabilizaciju molekula u prethodnoj reakciji omogućava heksozni prsten, koji se može podijeliti na fruktoz-bisulfat aldolazu i dva triozna šećera: dihidroksiaceton fosfat (ketoza) i gliceraldehid 3-fosfat (aldoza). Postoje dvije klase aldolaza:
- klase I je prisutna u životinja i biljaka, a
- klasa II se javlja u gljivica i bakterija; dvije klase koriste različite mehanizme u vezanju na ketozni prsten.
Delokalizirani elektroni u cijepanju ugljik-ugljik veze, spajaju se sa alkoholom grupom. Rezultirajući ugljik je stabiliziran ugljičnom samom strukturom, preko distribucije rezonance punjenja i prisustvom napunjenih ionskih protetskih grupa.
↓
Kompleksna enzimska reakcija
Glavni supstrat: β-D-Fruktozo 1,6-bisfosfat (F1,6BP)

Glavni produkt-1: D-gliceraldehid 3-fosfat (GADP)

Glavni produkt-2: Dihidroksiaceton fosfat (DHAP)

Enzim - napredujući: frutozo-bifofat aldolaza (ALDO) (jedna od lijaza
Reakcija: Reverzibilna
Triosefosfat izomeraza brzo interkonvertira dihidroksiaceton fosfata, gliceraldehid 3-fosfatom ( 'GADP' ) koji izlazi dalje iz glikolize. Ovo je prednost, jer usmjerava dihidroksiaceton fosfat niz isti put kao gliceraldehid 3-fosfat, što je pojednostavljenje uobičajenog puta.
↓
Enzimska reakcija
Enzim: triosefosfat izomeraza (TPI), jedna od izomeraza
Supstrat: Dihidroksiaceton fosfat (DHAP)
Produkt: D-gliceraldehid 3-fosfat (GADP)
Smjer reakcije: Reverzibilna


Faza naplate[uredi | uredi izvor]
Druga polovini glikolize je poznata kao faza naplate ili faza isplate, određena u neto dobiti u obliku energetski bogatih molekula ATP i NADH. U pripremnoj fazi put od glukoze vodi do dva triozna šećera, a u svakoj reakcija u ovoj fazi se javljaju dva puta po jedna mala molekula. Tako se dobiju dvije molekule NADH i četiri molekule ATP, što daje neto dobit od 2 NADH i 2 ATP molekule, iz glikolitskog puta po molekuli glukoze.
Triozni šećeri su dehidrogenizirani neorganski fosfati, koji formiraju 1,3-bisfosfoglicerat.
Za redukciju su upotrebljene dvije molekule NAD+, vodikovog nosača, za dobijanje NADH + H+ za svaku triozu.
Atom vodika uravnotežuje naboje, pa se oba održavaju jer fosfatna (Pi) grupa zapravo postoji u obliku ortofosfornog kiselinskog aniona HPO4 2−, koji disocira i daje dodatni H+ ion i daje neto naboj u iznosu od -3 na obje strane.
↓
Enzimska reakcija:
Enzim: Gliceraldehid phosfat dehidrogenaza (GAPDH)
jedna od oksidoreduktaza
Supstrat: Gliceraldehid 3-fosfat (GADP)
Produkt: D-1,3-bisfosfoglicerat (1,3BPG)
Smjer reakcije: Reverzibilna
Naredni supstrat: NAD+ + Pi
Naredni produkt: NADH + H+


Na ovom koraku odvija se enzimski transfer fosfatne grupe 1,3-bisfosfoglicerata na ADP pomoću fosfoglicerat kinaze, formirajuči ATP i 3-fosfoglicerata. Ovdje se glikoliza završava prelomnom tačkom: potrošene su dvije molekule ATP. a dvije nove molekule su upravo sintetizirane. Taj korak podrazumijeva jednu od dvije razine fosforilizacije supstrata i zahtijeva ADP. Stoga se, kada ćelija ima dosta ATP (i malo ADP), ova reakcija ne događa . Jer, ako se ne metabolizira, ATP se raspada relativno brzo, što je važna regulatorna pojava u glikolitskom putu.
ADP zapravo postoji kao ADPMg-, a ATP kao ATPMg<sup 2-, koji su odgovorni za balansiranje na -5 obje strane.
Kofaktori:
Mg 2+
↓
Enzimska reakcija
Enzim: Fosfoglicerat kinaza ( 'PGK' )
jedna od transferaza
↓
Enzimska reakcija
Enzim: Fosfoglicerat kinaza (PGK)
jedna od transferaza
Reverzni enzim: Fosfoglicerat kinaza (PGK)
Supstrat: 1,3-bisfosfoglicerat (1,3-BPG)
Produkt: 3-fosfoglicerat (3PG)
Smjer reakcije: Reverzibilna
Mali produkt: ADP
Naredni produkt: ATP


Fosfoglicerat mutaza sada u obliku 2-fosfoglicerata.
↓
Enzimska reakcija
Enzim: Fosfoglicerat mutaza (PGM)
jedna od mutaza
Supstrat: 3-fosfoglicerat (3PG)
Produkt: 2-fosphoglicerat (2PG)
Smjer reakcije: Reverzibilna

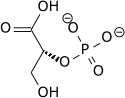
Enolaza naredna forma fosfoenolpiruvat iz 2-fosfoglcerata.
Kofaktori:
2 Mg2+: jedan "konformacijski" ion za koordinaciju sa karboksilatnom grupom supstrata, a drugi katalitski ion koji učestvuje u dehidraciji.
↓
Enzim]]ska reakcija
Enzim: Enolaza (ENO)
jedna od lijaza
Reverzni enzim: Enolaza (ENO)
Supstrat: 2-fosfoglicerat (2PG)
Produkt: fosfoenolpiruvat (PEP)
Smjer reakcije: Reverzibilna
Mali produkt: H2O

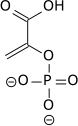
Konačna podloga na razini fosforilacije sada formira molekulu piruvata i molekula ATP, putem enzima piruvat kinaza. Ovo služi kao dodatni regulacijski korak, slično koraku fosfoglicerat kinaze.
Kofaktori:
Mg2+
↓
Enzimska reakcija
Enzim: Piruvat kinaza (PK), jedna od transferaza
Supstrat: Fosfoenolpiruvat (PEP)
Produkt: Piruvat (Pyr)
Smjer reakcije: Napredujući
Mali dodatak: ADP + H+
Mali produkt: ATP


Regulacija[uredi | uredi izvor]
Glikoliza je regulirana usporavanjem ili ubrzavanjem određenih koraka u u svm toku, inhibirajući ili aktivirajući uključene enzyme. Opisani koraci mogu se odrediti izračunavanjem promjene u slobodnoj energije, ΔG , za svaki od njih.
Kada je ΔG negativan, reakcija se odvija spontano samo u smjeru naprijed i smatra se nepovratnom.
Kada ΔG je pozitivan, reakcija je nespontany i neće se nastaviti u smjeru naprijed, osim u kombinaciji sa energetski povoljnom reakcijom.
Kada ΔG je nula, reakcija je u ravnoteži, a može nastaviti u bilo kojem pravcu i smatra se reverzibilnom.
Ako je korak u ravnoteži (ΔG je nula), enzim koji katalizira reakciju će uravnotežiti proizvode i reaktanate i ne može da odrediti smjer puta. Ovi koraci (i povezani enzimi) smatraju nereguliranim. Ako korak nije u ravnoteži, ali je spontan (ΔG je negativan), katalizirajući enzim reakcije ne balansira proizvode i reaktanate i smatra se reguliranim. Zajednički mehanizam reguliranja enzima je alosterna kontrola.
Promjene slobodne energije[uredi | uredi izvor]
| Sastojak | Koncentracija / mM |
|---|---|
| Glukoza | 5.0 |
| Glukosa-6-fosfat | 0.083 |
| Fruktoza-6-fosfat | 0.014 |
| Fruktoza-1,6-bisfosfat | 0.031 |
| Dihidroksiaceton fosfat | 0.14 |
| Gliceraldehid-3- fosfat | 0.019 |
| 1,3-Bisfosfoglicerat | 0.001 |
| 2,3-Bisfosfoglicerat | 4.0 |
| 3-Fosfoglicerat | 0.12 |
| 2-Fosfoglicerat | 0.03 |
| Fosfoenolpiruvat | 0.023 |
| Piruvat | 0.051 |
| ATP | 1.85 |
| ADP | 0.14 |
| Pi | 1.0 |
 | |
Promjena u slobodnoj energiji, ΔG , za svaki korak u glikoliznom putu može se izračunati po obrascu:
ΔG = Δ'G ° + RTlnQ;
Q= kvocijent reakcije.
To zahtijeva poznavanje koncentracije metabolita. Sve ove vrijednosti su na raspolaganju u eritrocitima, sa izuzetkom koncentracija NAD + i NADH. Odnos NAD+ u NADH u citoplazmi je oko 1.000, što čini oksidaciju gliceraldehid-3-fosfat (korak 6) povoljnijom.
Koristeći izmjerene koncentracije svakog koraka I promjene standardne slobodne energije, može se izračunati njena stvarna promjena.
| Korak | Reakcija | ΔG°' / (kJ/mol) | ΔG / (kJ/mol) |
|---|---|---|---|
| 1 | Glukoza+ ATP4− → Glukoza-6-fosfat2− + ADP3− + H+ | -16.7 | -34 |
| 2 | Glukoza-6- fosfat 2− → Fruktoza-6- fosfat 2− | 1.67 | -2.9 |
| 3 | Fruktoza-6- fosfat 2− + ATP4− → Fruktoza -1,6-bisfosfat 4− + ADP3− + H+ | -14.2 | -19 |
| 4 | Fruktoza-1,6-bis fosfat 4− → Dihidroksiaceton fosfat 2− + Gliceraldehid-3- fosfat 2− | 23.9 | -0.23 |
| 5 | Dihidroksiaceton fosfat 2− → Gliceraldehid-3- fosfat 2− | 7.56 | 2.4 |
| 6 | Gliceraldehid-3- fosfat 2− + Pi2− + NAD+ → 1,3-Bisfosfoglicerat4− + NADH + H+ | 6.30 | -1.29 |
| 7 | 1,3-Bisfosfoglicerat4− + ADP3− → 3-Fosfoglicerat3− + ATP4− | -18.9 | 0.09 |
| 8 | 3-Fosfoglicerat3− → 2-Fosfoglicerat3− | 4.4 | 0.83 |
| 9 | 2-Fosfoglicerat3− → Fosfoenolpiruvat3− + H2O | 1.8 | 1.1 |
| 10 | Fosfoenolpiruvat3− + ADP3− + H+ → Piruvat− + ATP4− | -31.7 | -23.0 |
Prema mjerenju fiziološke koncentracije metabolita u eritrocitima, čini se da je oko sedam koraka u glikolizi u ravnoteži za tu vrstu ćelija. Tri koraka - one s velikim negativnim promjene slobodne energije - nisu u ravnoteži i nazivaju se nepovratnim ; takvi koraci su često predmet regulacije.
Korak 5 na slici je prikazan iza drugih koraka, jer je bočna reakcija koja može smanjiti iili povećati koncentraciju srednjeg gliceraldehid-3-fosfata. Taj sastojak se pretvara u dihidroksiaceton fosfat pomoću enzima trioza fosfat izomeraza, koji je katalitski savršen enzim; stops je tako brza da se za reakciju može pretpostaviti da je u ravnoteži. Činjenica da ΔG nije nula, ukazuje stvarne koncentracije u eritrocitima nisu precizno poznate.
Biohemijska osnova[uredi | uredi izvor]
Postojanje više od jednog aspekta regulacije ukazuje na to da posrednici između tih mjesta, ulaze i izlaze iz glikoliznog puta drugim postupcima. Na primjer, u prvom reguliranom koraku, heksozakinaza pretvara glukozu u glukoza-6-fosfat. Umjesto nastavka kroz glikolizu, ovaj srednji se može pretvoriti u molekule glukoze u molecule za skladištenje, kao što su glikogen ili skrob. Obrnuta reakcija, pri razgradnji, npr., glikogena, proizvodi se uglavnom glukoza-6-fosfat, dok se u toj reakciji formira vrlo malo slobodne glukoze. Tako proizveden glukoza-6-fosfat može ući u glikolizu, ' nakon’' prve kontrolne tačke.
U drugom koraku regulacije (treći korak glikolize), fosfofruktokinaza pretvara fruktoza-6-fosfat u fruktoza-1,6-bisfosfat, koji se onda pretvara u gliceraldehid-3-fosfat i dihidroksiaceton fosfat. Dihidroksiaceton fosfat se može ukloniti iz glikolize, konverzijom u glicerol-3-fosfat, koji se može koristiti za formiranje triglicerida.[9] U konverziji, trigliceridi se mogu razložiti na masne kiseline i glicerol, koji se može pretvoriti u dihidroksiaceton fosfat, koji može ući u glikolizu nakon druge kontrolne tačke.
Način regulacije[uredi | uredi izvor]
Tri regulatorna enzima su
Tok kroz glikoliticki put je prilagođen odgovoru na uvjete i unutar i izvan ćelije. Stopa reakcijau jetri je regulirana da zadovolji glavne ćelijske potrebe:
- (1) proizvodnju ATP,
- (2) stvaranje blokova za biosintetske reakcije, i
- (3) smanjenje glukoze u krvi, kao jedne od glavnih funkcija jetre. Kada šećer u krvi padne, glikoliza u jetri se zaustavlja , kako bi se omogućio obrnuti proces, glukoneogeneza. U glikolizi, reakcije koje su katalizirane heksozakinazom, fosfofruktokinazom I piruvat kinazeom su, u većini organizama, praktično nepovratan proces. U metaboličkim putevima, enzimI su potencijalne lokacije kontrole i sva tri ova enzima, u glikolizi, mogu poslužiti u tu svrhu.
Heksokinaza[uredi | uredi izvor]

Ovo je važno kada je nivo glukoze u krvi su visok. Tokom hipoglikemije, glikogen se može reverzibilno pretvoriti u G6P, a zatim u glukozu od enzima za jetru specifične glukoza 6-fosfataze i pušta u krv bez podešavanja niske koncentracije otpuštane glukoze. Ovs obrnuta reakcija ima važnu ulogu u jetrenim ćelijama, za održavanje razine šećera u krvi za vrijeme posta. Kritično je neophodna za rad mozga, jer u većini slučajeva, kao izvor energije, mozak koristi glukozu
Fosfofruktokinaza[uredi | uredi izvor]
Fosfofruktokinaza je značajna kontrolna tačka u glikolitskom putu, jer je to je jedan od nepovratnih koraka i ima ključ alosternih efektora, adenozin monofosfat g a i fruktoza 2,6-bisfosfata (F2,6BP).
Fruktoza 2,6-bisfosfat (F2,6BP) je vrlo moćan aktivator fosfofruktokinaze (PFK-1) koja se stvara kada se F6P fosforilizira drugom fosfofruktokinazom (PFK2). U jetri, kada niska razina šećera u krvi je i glukagon podiže ‘’cAMP’’, PFK2 fosforilizira protein kinazu A. Fosforilaciju deaktivira PFK2, a druga domena na ovaj protein postaje aktivna kao fruktoza bisfosfataza-2, koji pretvara F2,6BP natrag na F6P. Oba glukagon i adrenalin uzrokovati visok nivo kamp u jetri. Rezultat nižih nivoa jetre fruktoza-2,6-bisfosfat je pad aktivnosti od phosphofructokinase i povećanje aktivnosti fruktoza 1,6-bisfosfataza, tako da glukoneogeneze (u suštini, " glikolize u obrnutom ") koji je omiljen. To je u skladu s ulogom jetre u takvim situacijama, jer je odgovor jetre do ovih hormona će objaviti glukoze u krvi.
Adenozin trifosfat se natječe sa adenozin monofosfatom za efektora alosternog mjesta na PFK enzimu. Koncentracije adenozintrifosfata u ćelijama su mnogo veće od onih kod adenozin monofosfata, obično 100 puta veće, ali se koncentracija ATP, pod fiziološkim uvjetima, ne mijenja više od oko 10%, dok je pad od 10% u ATP rezultat u 6 puta većoj količini u adenozin monofosfata. Dakle, relevantnost. ATP kao alosternog efektora je pod znakom pitanja. Povećanje AMP je posljedica smanjenja energijskog punjenja u ćeliji.
Prilikom testiranja in vitro , citrat inhibira fosfofruktokinazu, povećanjem inhibitornog učinka ATP. Međutim, pitanje je da li je ovo značajan efekt u uvjetima in vivo, jer se citrat u citosolu koristi uglavnom za konverziju u acetil-CoA za sintezu masnih kiselina i holesterola.
Piruvat kinaza[uredi | uredi izvor]

Piruvat kinaza je enzima koji katalizira posljednji korak glikolize, u kojem se formiraju piruvat i ATP. Piruvat kinaza katalizira transfer fosfatne grupe, sa fosfoenolpiruvat a (PEP) na adenozin difosfat, donoseći po jednu molekulu piruvata I adenozin trifosfata
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Webster's New International Dictionary of the English Language, 2nd ed. (1937): Merriam Company, Springfield, Mass.
- ^ http://biology.about.com/od/cellularprocesses/a/aa082704a.htm Arhivirano 15. 5. 2013. na Wayback Machine.
- ^ a b Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London,ISBN 0-674-30775-5, ISBN 0-674-30776-3.
- ^ Graeme K. Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Nelson D. L., Michael M. Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman, 2013.ISBN 978-1-4641-0962-1.
- ^ Glikoliza & ndash; Animacija i Napomene
- ^ a b Garrett R., Grisham C. M. (2005): Biochemistry, 3rd Ed. Thomson Brooks/Cole, Belmont, CA ISBN 0-534-49033-6.
- ^ Berg J. M., Tymoczko J. L., Stryer L. (2007): Biochemistry, 6th Ed. Freeman and Comp, New York, ISBN 0716787245.
Vanjski linkovi[uredi | uredi izvor]
- A Detailed Glycolysis Animation provided by IUBMB ([http://get.adobe.com/flashplayer/ Adobe Flash potreban)
- The Glycolytic enzymes in Glycolysis na RCSB PDB
- Glycolytic cycle with animations na wdv.com
- Metabolism, Cellular Respiration and Photosynthesis - The Virtual Library of Biochemistry and Cell Biology na biochemweb.org
- notes on glycolysis Arhivirano 11. 6. 2008. na Wayback Machine na rahulgladwin.com
- The chemical logic behind glycolysis na ufp.pt
- Expasy biochemical pathways poster na ExPASy
- metpath: Interactive representation of glycolysis
