Izomeraza

Izomeraze su opća klasa enzima, koki pretvaraju mulekulu jednog izomera u drugi. Izomeraze mogu olakšati unutrašnja preuređivanja, u kojima se kidaju formirane veze ili mogu katalizirati konformacijske promjene. Opći oblik takve reakcije je kako slijedi:
A–B → B–A.
Za njih postoji samo jedan supstrat koji daje jedan proizvod. Ovaj proizvod ima isti molekulsku formulu kao podloga, ali se razlikuje u podešavanju veza ili prostornom aranžmanu. Izomeraze kataliziraju mnogih važnih bioloških procesa, kao što su glikoliza i metabolizam ugljikohidrata.[1][2][3][4][5]
Izomerizacija[uredi | uredi izvor]
Izomeraze kataliziraju promjene unutar jedne moleKule. One pretvaraju jedan izomer u drugi, što znači da krajnji proizvod ima istu molekulsku formulu ali različitu fizičku strukturu. Izomeri postoje u mnogim varijantama, ali se generalno mogu svrstati kao strukturni izomeri ili stereoizomeri. Strukturni izomeri imaju drugačiji način vezivanja i / ili različitiu povezljivost jednih veza sa drugim, kao što je slučaj u heksan ima, sa četiri izomerna oblika (2-metilpentan, 3-metilpentan , 2,2-dimetilbutan, i 2,3-dimetilbutan).
Stereoizomeri imaju isti raspored pojedinih veza i ista povezivanja, ali se ralikuju po trodimenzionalnom rasporedu vezanih atoma. Primjerice, 2-buten postoji u dva izomerna oblika: cis-2-buten i trans-2-buten. Pod-kategorije izomeraze sadrže racemaze, epimerize, a cis-trans izomeri su primjeri enzima koji kataliziraju interkonverziju stereoizomera. Unutarmolekulska lijaza, oksidoreduktaza i transferaza kataliziraju unutrašnju konverziju strukturnih izomera.[6]
Klasifikacija[uredi | uredi izvor]
Svaki enzim koji katalizira neku reakciju ima jedinstven klasifikacijski broj. Reakcije koje su katalizirane izimerazama imaju sopstveniu EC kategoriju (Enzyme Commission number): EC 5. Izomeraze se dalje dijele u šest sub-klasa:
- EC 5.1 - kataliziraju racemizaciju i epimerizaciju;
- EC 5.2 - kataliziraju geometrijsku izomeraciju (cis-trans);
- EC 5.3 - intermolekularne oksidoreduktaze;
- EC 5.4 - intermolekularne transferaze;
- EC 5.5 - intermolekularne liaze;
- EC 5.99 - ostale izomeraze.
Racemaze i epimeraze[uredi | uredi izvor]
Kategorija (EC 5.1) uključuje racemaze i epimeraze. Ove izomeraze invertiraju stehiometrijsku metu u hiralnom ugljiku. Za stereohemijsku inverziju racemaze djeluju na molekula s jednim hiralnim ugljikom, a ciljna molekula epimeraza je s više hiralnih ugljika i djeluje na jedan od njih. Molekula sa samo jednim hiralnim ugljikom ima dva enantiomerna oblika, kao što serinski imaju izoforme D-serin i L-serin, koji se razlikuju samo u apsolutnoj konfiguraciji hiralnog ugljika. Neka molekula s više hiralnih ugljika ima dva oblika u svakom od hiralnih ugljika. Izomerizacije na jednom hiralnom ugljiku od nekoliko prinosa epimere, koje se razlikuju jedna od druge u apsolutnom konfiguraciji na samo jedan kiralnih ugljik. Naprimjer, D-glukoza i D- manoza se razlikuju u konfiguraciji na samo jednom hiralnom ugljiku. Ova klasa se dalje dijeli na grupe enzima koji djeluju prema slijedećem pregledu.
| EC Broj | Supstance na koje djeluju | Primjeri |
|---|---|---|
| EC 5.1.1 | Aminokiseline i njihovi derivati | Alanin racemaza, Metionin racemaza |
| EC 5.1.2 | Laktat racemaza, Tartrat epimeraza | |
| EC 5.1.3 | Ugljikohidrati i njihovi derivati | Ribulza-fosfat 3-epimeraza, UDP-glukoza 4-epimeraza |
| EC 5.1.99 | Ostala jedinjenja | Metilmalonil CoA epimeraza, Hidancijska racemaza |
Cis-trans izomeraze[uredi | uredi izvor]
Ova kategorija (EC 5.2) uključuje enzime koji kataliziraju izomerizaciju cis-trans izomera. Alkeni i cikloalkani mogu imati cis-trans stereoizomere. Njih ne izdvaja apsolutna konfiguracija već i položaj srodne supstitucijske grupe u odnosu ravan reference, preko dvostruke veze ili u odnosu na strukturu prstena. Cis izomeri imaju supstituent na istoj strani, a trans izomeri imaju grupe na suprotnim stranama.
Ova kategorija se dalje ne dijeli na niže subkategorije. Ova kategorija uključuje:

Unutarmolekulske oksidoreduktaze[uredi | uredi izvor]
Ova kategorija (EC 5.3) uključuje intramolekulske oksidoreduktaze. Ove izomeraze kataliziraju prijenos elektrona iz jednog dijela molekule na drugi. Drugim riječima, oni katalizirati oksidaciju j ednog dijela molekule i istovremenu redukciju drugog dijela.[7] Pod-kategorije ove klase su:

| EC Broj | Supstanca na koju djeluje | Primjeri |
|---|---|---|
| EC 5.3.1 | Interkonvertirajuće aldoze i ketoze | Trioza-fosfat izomeraza, Riboza-5-fosfat izomeraza |
| EC 5.3.2 | Interkonvertirajuće keto- i enol-grupe | Fenilpiruvat tautomeraza, Oksaloacetat tautomeraza |
| EC 5.3.3 | Premještanje C=C dvostrukih veza | Steroid delta-izomeraza, L-dopahrom izomeraza |
| EC 5.3.4 | Premještanje S-S veza | Protein disulfid-izomeraza |
| EC 5.3.99 | Ostale unutarmolekulske oksidoreduktaze | Prostaglandin-D sintaza, Alen-oksid ciklaza |
Unutarmolekulske transferaze[uredi | uredi izvor]
Ova kategorija (EC 5.4) uključuje intramolekulske transferaze (mutaze). Kataliziraju transfer funkcijskih grupa iz jednog dijela molekule drugi. Fosfotransferaze (EC 5.4.2) su do 1983. bile kategorizirane kao transferaze (EC 2.7.5) sa regeneracijom donora.[8] Ova sub-klasa se može podijeliti prema funkcijskoj grupi enzimskog transfera:
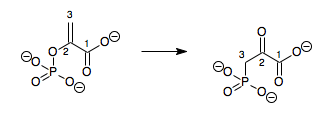
| EC Broj | Supstanca na koju djeluje | Primjeri |
|---|---|---|
| EC 5.4.1 | Transfer acil grupa | Lizolecitin acilmutaza, Prekorin-8X metilmutaza |
| EC 5.4.2 | Fosfotransferaze (Fosfomutaze) | Fosfoglukomutaza, Fosfopentomutaza |
| EC 5.4.3 | Transfer amino grupa | Beta-lizin 5,6-aminomutaza, Tirozin 2,3-aminomutaza |
| EC 5.4.4 | Transfer hidroksigroupe | (hidroksiamino)benzen mutaza, Izohorizmat sintaza |
| EC 5.4.99 | Transfer ostalih grupa | Metilaspartat mutaza, Horizmat mutaza |
Unutarmolekulske lijaze[uredi | uredi izvor]
Ova kategorija (EC 5.5) uključuje intramolekulske lijaze. Ovi enzimi kataliziraju "reakcije u kojoj grupa koja se može smatrati eliminiranom iz jednog dijela molekule, ostavljajući dvostruku vezu, dok je preostala kovalentna pridodata molekuli“. Neke od tih katalitskih reakcija uključuju razgradnju strukture prstena. Ova kategorija se ne dijeli na niže razine, a uključuje:

Unutarmolekulske oksidoreduktaze[uredi | uredi izvor]
Ova kategorija (EC 5.3) uključuje intramolekulske oksidoreduktaze. Ove izomeraze kataliziraju prijenos elektrona iz jednog dijela molekule na drugi. Drugim riječima, oni katalizirati oksidaciju j ednog dijela molekule i istovremenu redukciju drugog dijela.[7] Pod-kategorije ove klase su:

| EC Broj | Reakcija i/ili grupa na koju djeluje | Primjeri |
|---|---|---|
| EC 5.3.1 | Interkonvertirajuće aldoze i ketoze | Trioza-fosfat izomeraza, Riboza-5-fosfat izomeraza |
| EC 5.3.2 | Interkonvertirajuće keto- i enol-grupe | Fenilpiruvat tautomeraza, Oksaloacetat tautomeraza |
| EC 5.3.3 | Premještanje C=C dvostrukih veza | Steroid delta-izomeraza, L-dopahrom izomeraza |
| EC 5.3.4 | Premještanje S-S veza | Protein disulfid-izomeraza |
| EC 5.3.99 | Ostale unutarmolekulske oksidoreduktaze | Prostaglandin-D sintaza, Alen-oksid ciklaza |
Unutarmolekulske transferaze[uredi | uredi izvor]
Ova kategorija (EC 5.4) uključuje intramolekulske transferaze (mutaze). Kataliziraju transfer funkcijskih grupa iz jednog dijela molekule drugi. Fosfotransferaze (EC 5.4.2) su do 1983. bile kategorizirane kao transferaze (EC 2.7.5) sa regeneracijom donora.[8] Ova sub-klasa se može podijeliti prema funkcijskoj grupi enzimskog transfera:

| EC Broj | Reakcija na koju djeluje | Primjeri |
|---|---|---|
| EC 5.4.1 | Transfer acil grupa | Lizolecitin acilmutaza, Prekorin-8X metilmutaza |
| EC 5.4.2 | Fosfotransferaze (Fosfomutaze) | Fosfoglukomutaza, Fosfopentomutaza |
| EC 5.4.3 | Transfer amino grupa | Beta-lizin 5,6-aminomutaza, Tirozin 2,3-aminomutaza |
| EC 5.4.4 | Transfer hidroksigroupe | (hidroksiamino)benzen mutaza, Izohorizmat sintaza |
| EC 5.4.99 | Transfer ostalih grupa | Metilaspartat mutaza, Horizmat mutaza |
Unutarmolekulske lijaze[uredi | uredi izvor]
Ova kategorija (EC 5.5) uključuje intramolekulske lijaze. Ovi enzimi kataliziraju "reakcije u kojoj grupa koja se može smatrati eliminiranom iz jednog dijela molekule, ostavljajući dvostruku vezu, dok je preostala kovalentna pridodata molekuli“. Neke od tih katalitskih reakcija uključuju razgradnju strukture prstena. Ova kategorija se ne dijeli na niže razine, a uključuje:

Ligaze[uredi | uredi izvor]

Kategoriji EC 6 pripadaju liigaze, koje povezuju dvije molekule putem kovalentne veze. Njima je potrebna energija, koja dolazi iz nukleozid trifosfata (NTP). Druge molekule kao što su NAD+ mogu poslužiti kao dobavljači. Od njih se može regenerirati između ostalog i potrošena ATP.
U EC sistemu klasifikacije , ligaze su brojevima pod EC | 6 ..-.--. Druga oznaka precizno definira prirodu veze:
| EC broj | Kataliza veze |
|---|---|
| EC -.-.6.1 | Veza ugljik - kisik |
| EC 6.2.-.- | Veza ugljik - sumpor |
| EC 6.3.-.- | Veza ugljik - dušik |
| EC -.-.6.4 | Veza dva atoma ugljika |
| EC 6.5.-.- | Formiranje fosfor ester karboksi-cis,cis-mukonat ciklaze |
| EC -.-6.6. | Formiranje veza dušik - metal |
Industrijska primjena[uredi | uredi izvor]
Daleko najčešći način korištenja izomeraze u industrijskim aplikacijama je u proizvodnji šećera. Glukoizomeraza (poznata i kao ksiloza izomeraza) katalizira konverziju D - ksiloze i D - glukoze u D - ksilulozu i D - fruktozu. Kao i većina šećernih izomeraza, glukoizomeraza katalizira međukonverziju u aldozama i ketozama.
Pretvaranje glukoze u fruktoze je ključna komponenta u proizvodnji visoko fruktoznog kukuruznog sirupa. Izomerizacija je konkretnija od starijih hemijskih metoda proizvodnje fruktoze, što je rezultiralo većim prinosom fruktoze, bez nusproizvoda. Fruktoza koja je proizvedena ovom izomerizacijskom reakcijom je čistija i bez ostatka okusa od zagađivača. Visoko fruktozni kukuruzni sirup se preferira u proizvodnji bombona i gaziranih napitaka, zbog visoke moći zaslađivanja fruktozom (dva puta veća od saharoze), relativno niske cijene i nemogućnosti kristalizacije. Fruktoza se također koristi kao zaslađivač za oboljele od dijabetesa. Glavna pitanja korištenja glukoizomeraze uključiti njenu inaktivaciju na višim temperaturama i potrebu za visokom pH (između 7,0 i 9,0) u okruženju reakcije. Umjereno visoke temperature, iznad 70 °C, mogu povećati prinos fruktoze za najmanje pola izomerizacijog puta.[9]
Za vrhunac aktivnosti, enzim zahtijeva divalentni ion kalcija, kao što su Co2+ i Mg2+, što je dodatni trošak za proizvođače. Glukoizomeraza također ima mnogo veći afinitet za ksilozu nego za glukozu, što zahtijeva pažljivo kontrolirane uvjete.[10] Izomerizacija ksiloze u ksilulozu ima komercijalnu primjenu u proizvodnji biogoriva, što je povećalo interesovanje za ovaj provces. Ova reakcija se često vidi prirodno kod detritivornih bakterija koje se hrane raspadajućim biljnim ostacima (detritusom). Njegova najčešća upotreba je u industrijskoj proizvodnji etanola, da bi se ostvarila fermentacija ksiluloze.
Upotreba hemiceluloze kao izvornog materijala je vrlo česta. Hemiceluloza sadrži ksilan, koji se i sam sastoji od ksiloze sa β (1,4) vezama. Upotreba glukoizomeraze je vrlo efikasna za pretvaranje ksiloze u ksilulozu, koja se onda može izložiti fermentaciji pomoću kvasaca. Sve u svemu, opsežna istraživanja u oblasti genetićkog inženjerstva je uložila u optimizaciju glukoizomeraze i olakšavanje njenog oporavka od industrijskih aplikacija za ponovnu upotrebu.[11] Glukoizomeraza je u stanju da katalizira izomerizaciju niza drugih šećera, uključujući i D -ribozu, D-alozu i L - arabinozu. Najefikasnije podloge su one slične glukozi i ksilozi, koje imaju cikloheksansku konformaciju hidroksilne grupe na trećem i četvrtom ugljiku. Sadašnji model za mehanizam glukoizomerizacije je da se od sigmatropska reakcija reakcija, zasnovan na kristalografiji X-zracima i izotopima.
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London,ISBN 0-674-30775-5, ISBN 0-674-30776-3.
- ^ Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1.
- ^ Bajrović K., Čaušević-Jevrić A., Hadžiselimović R., Eds (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 978-9958-9344-8-3.
- ^ McNaught A. D. (1997): Compendium of chemical terminology, 2nd Ed. Blackwell Scientific Publications, Oxford, ISBN 0-9678550-9-8: http://goldbook.iupac.org.
- ^ a b NC-IUBMB; Edwin C. (1992): Enzyme nomenclature 1992 : recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the nomenclature and classification of enzymes, 6th Ed. Published for the International Union of Biochemistry and Molecular Biology by Academic Press, San Diego, ISBN 0-12-227164-5.
- ^ a b Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB) (2010): The enzyme list Class 5 – Isomerases: http://www.enzyme-database.org/downloads/ec5.pdf.
- ^ Baker S. A. (1976): Pure fructose syrups. Process Biochemistry, 11: 20–25.
- ^ Antrim R. L., Colilla W., Schnyder B. J. (1979): Glucose isomerase production of high fructose syrups. Applied Biochemistry and Bioengineering, 2: 97–155.
- ^ Wang P. Y., Shopsis C., Scheider H. (1980): Fermentation of a pentose by yeasts|journal. Biochemical and Biophysical Research Communications, 94 (1): 248–254|pmid=6446306|doi=10.1016/s0006-291x(80)80213-0.
Vanjski linkovi[uredi | uredi izvor]
- EC 5 Introduction (en)



