ALAD
, selo u Iranu
| Porfobilinogen-sintaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 DALA-dehidrataza} | |||||||||
| Identifikatori | |||||||||
| EC broj | 4.2.1.24 | ||||||||
| CAS broj | 9036-37-7 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA unos | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG unos | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| PDB strukture | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologija gena | AmiGO / QuickGO | ||||||||
| |||||||||
| Delta- aminolevulinska kisela dehidrataza | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Simbol | ALAD | ||||||
| NCBI gen | 210 | ||||||
| HGNC | 395 | ||||||
| OMIM | 125270 | ||||||
| RefSeq | NM_001003945 | ||||||
| UniProt | P13716 | ||||||
| Ostali podaci | |||||||
| EC broj | 4.2.1.24 | ||||||
| Lokus | Hrom. 9 q32 | ||||||
| |||||||
| ALAD | |
|---|---|
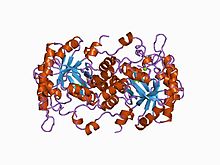 Kristalna struktura visoke rezolucije 5-aminolevulinske kiseline zavisne od Mg2+ dehidrataze | |
| Identifikatori | |
| Simbol | ALAD |
Delta-aminolevulinska kisela dehidrataza (porfobilinogen-sintaza ili ALA dehidrataza ili aminolevulinat-dehidrataza) jest enzim (EC 4.2.1.24) koji je kod ljudi kodiran genom ALAD.[5][6] Porfobilinogen-sintaza (ili ALA-dehidrataza ili aminolevulinat-dehidrataza) sintetizira porfobilinogen asimetričnom kondenzacijom dvije molekule aminolevulinske kiseline. Svi prirodni tetrapiroli, uključujući hemove, hlorofile i vitamin B12, dijele porfobilinogen kao zajednički prekursor. Porfobilinogen-sintaza je prototip morfeina.[7]
Aminokiselinska sekvenca[uredi | uredi izvor]
Dužina polipeptidnog lanca je 330 aminokiselina, а molekulska težina 36.295 Da.[8]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MQPQSVLHSG | YFHPLLRAWQ | TATTTLNASN | LIYPIFVTDV | PDDIQPITSL | ||||
| PGVARYGVKR | LEEMLRPLVE | EGLRCVLIFG | VPSRVPKDER | GSAADSEESP | ||||
| AIEAIHLLRK | TFPNLLVACD | VCLCPYTSHG | HCGLLSENGA | FRAEESRQRL | ||||
| AEVALAYAKA | GCQVVAPSDM | MDGRVEAIKE | ALMAHGLGNR | VSVMSYSAKF | ||||
| ASCFYGPFRD | AAKSSPAFGD | RRCYQLPPGA | RGLALRAVDR | DVREGADMLM | ||||
| VKPGMPYLDI | VREVKDKHPD | LPLAVYHVSG | EFAMLWHGAQ | AGAFDLKAAV | ||||
| LEAMTAFRRA | GADIIITYYT | PQLLQWLKEE |
Funkcija[uredi | uredi izvor]
Ovaj enzim katalizira sljedeću reakciju, drugi korak biosinteze porfirina:
- 2 δ-aminolevulinska kiselina porfobilinogen + 2 H2O
Zbog toga katalizira kondenzaciju 2 molekule delta-aminolevulinata, kako bi nastao porfobilinogen (prekursor hema, citohroma i drugih hemoproteina). Ova reakcija je prvi uobičajeni korak u biosintezi svih bioloških tetrapirola. Za enzimsku aktivnost neophodan je cink
Struktura[uredi | uredi izvor]
Strukturna osnova za alosternu refulaciju porfobilinogen-sintaze (PBGS) je modulacija kvaternarne strukturne ravnoteže između oktamera i heksamera (putem dimera), koja je shematski predstavljena kao 6mer* ↔ 2mer* ↔ 2mer ↔ 8mer . * Predstavlja preorijentaciju između dva domena svake podjedinice koja se javlja u disociranom stanju. jer je sternost onemogućena u većim multimerima.[7]

PBGS je kodiran jednim genom i svaki PBGS multimer je sastavljen od više kopija istog proteina. Svaka PBGS podjedinica se sastoji od ~ 300 ostataka αβ-bačvastog domena, u kojem se nalazi aktivno mjesto enzima u njenom središtu i domene N-terminalnog kraka od > 25 ostataka. Alosterna regulacija PBGS-a može se opisati u smislu orijentacije domena αβ-bačve u odnosu na domen N-terminalnog kraka.
Svaki krak N-terminal ima do dvije interakcije s drugim podjedinicama u PBGS multimeru. Jedna od ovih interakcija pomaže u stabilizaciji "zatvorenog" konformacijskog poklopca aktivnog mjesta. Druga interakcija ograničava pristup rastvaraču s drugog kraja αβ-cijevi.
U neaktivnom multimernom stanju, domen kraka N-terminala nije uključen u interakciju koja stabilizuje poklopac, a u kristalnoj strukturi neaktivnog sklopa, poklopac aktivnog mjesta je poremećen.
Alosterni regulatori[uredi | uredi izvor]
Kao gotovo univerzalni enzim sa visoko konzerviranim aktivnim mjestom, PBGS ne bi bio primarna meta za razvoj antimikrobnih sredstava i/ili herbicida. Naprotiv, alosterna mjesta mogu biti mnogo više filogenetski promjenjiva od aktivnih mjesta, pa imaju više mogućnosti za razvoj lijekova.[7]
Filogenetičke varijacije u alosteriji PBGS dovode do uokvirivanja rasprave o alosternoj regulaciji PBGS u smislu unutrašnjih i vanjskih faktora.
Unutrašnji alosterni regulatori[uredi | uredi izvor]
Magnezij[uredi | uredi izvor]
Alosterni magnezijev ion leži na visoko hidratiziranom sučelju dva prooktamerna dimera. Čini se da se lahko odvaja, a pokazalo se da se heksameri akumuliraju pri uklanjanju magnezija in vitro.[9]
pH[uredi | uredi izvor]
Iako nije uobičajeno smatrati hidronijev ion kao alosterički regulator, u slučaju PBGS -a, pokazalo se da protonacija bočnog lanca na drugim mjestima osim na aktivnom mjestu utječe na ravnotežu kvartarne strukture, a time i na brzinu i njegova katalizirana reakcija.
Vanjski alosterni regulatori[uredi | uredi izvor]
Stabilizacija heksamera malih molekula[uredi | uredi izvor]
Pregledom PBGS 6mer* otkriva se površinska šupljina koja nije prisutna u oktameru. Predloženo je da se vezivanje malih molekula za ovu filogenetski promjenjivu šupljinu stabilizira heksamer* ciljanog PBGS -a i posljedično inhibira aktivnost.
Takvi alosterni regulatori poznati su kao morflokovi jer zaključavaju PBGS u određenom morfeinskom obliku (6mer*).[10]
Trovanje olovom[uredi | uredi izvor]
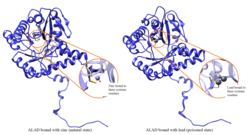
Olovo inhibira enzimsku aktivnost ALAD -a, počevši od razina olova u krvi za koje se nekad smatralo da su sigurne (<10 μg/dL) i nastavlja negativno korelirati u rasponu od 5 do 95 μg/dL.[11] Inhibicija ALAD -a olovom dovodi do anemija, prvenstveno jer inhibira sintezu hema i skraćuje životni vijek cirkulirajućih crvenih krvnih zrnaca, ali i stimulirajući pretjeranu proizvodnju hormona eritropoetina , što dovodi do neadekvatnog sazrijevanja crvenih krvnih ćelija od njihovih prekursora. Defekt u strukturnom genu ALAD-a može uzrokovati povećanu osjetljivost na trovanje olovom i akutnu jetrenu porfiriju. Identificirane su alternativno prerađene varijante transkripta, koje kodiraju različite izoforme.[12]
Nedostatak[uredi | uredi izvor]
Nedostatak porfobilinogen-sintaze obično se stiče (a ne nasljeđuje) i može biti uzrokovan trovanjem teškim metalima, posebno trovanjem olovom, jer je enzim vrlo osjetljiv na inhibiciju teških metala.[13]
Nasljedna insuficijencija porfobilinogen-sintaze naziva se porfibilinogen-sintazna (ili ALA dehidratazna) poprhirija). Izuzetno je rijedak uzrok porfirije,[14] sa manje od 10 prijavljenih slučajeva.[15] All disease associated protein variants favor hexamer formation relative to the wild type human enzyme.[14]
 |
PBGS kao prototip morfeina[uredi | uredi izvor]
Morfeinski model alosterije koji je ilustrirao PBG omogućva dodatni sloj razumijevanja potencijalnih mehanizama za regulaciju funkcije proteina i nadopunjuje povećani fokus koji naučna zajednica o proteinima stavlja na dinamiku strukture proteina.[7]
Ovaj model ilustrira kako se dinamika pojava, kao što su naizmjenične konformacije proteina, alternativna oligomerna stanja i prolazna interakcija protein-protein, može iskoristiti za alosternu regulaciju katalitske aktivnosti.
Reference[uredi | uredi izvor]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000148218 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000028393 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Eiberg H, Mohr J, Nielsen LS (februar 1983). "delta-Aminolevulinatedehydrase: synteny with ABO-AK1-ORM (and assignment to chromosome 9)". Clinical Genetics. 23 (2): 150–4. doi:10.1111/j.1399-0004.1983.tb01864.x. PMID 6839527. S2CID 27267679.
- ^ Beaumont C, Foubert C, Grandchamp B, Weil D, Gross MS, Nordmann Y (maj 1984). "Assignment of the human gene for delta aminolevulinate dehydrase to chromosome 9 by somatic cell hybridization and specific enzyme immunoassay". Annals of Human Genetics. 48 (2): 153–9. doi:10.1111/j.1469-1809.1984.tb01010.x. PMID 6378062. S2CID 24098976.
- ^ a b c d Jaffe EK, Lawrence SH (mart 2012). "Allostery and the dynamic oligomerization of porphobilinogen synthase". Archives of Biochemistry and Biophysics. 519 (2): 144–53. doi:10.1016/j.abb.2011.10.010. PMC 3291741. PMID 22037356.
- ^ "UniProt, P13716". Pristupljeno 5. 9. 2021.
- ^ Breinig S, Kervinen J, Stith L, Wasson AS, Fairman R, Wlodawer A, et al. (septembar 2003). "Control of tetrapyrrole biosynthesis by alternate quaternary forms of porphobilinogen synthase". Nature Structural Biology. 10 (9): 757–63. doi:10.1038/nsb963. PMID 12897770. S2CID 24188785.
- ^ Lawrence SH, Jaffe EK (2008). "Expanding the Concepts in Protein Structure-Function Relationships and Enzyme Kinetics: Teaching using Morpheeins". Biochemistry and Molecular Biology Education. 36 (4): 274–283. doi:10.1002/bmb.20211. PMC 2575429. PMID 19578473.
- ^ Abadin H, Ashizawa A, Stevens YW, Llados F, Diamond G, Sage G, Citra M, Quinones A, Bosch SJ, Swarts SG (august 2007). Toxicological Profile for Lead (PDF). Atlanta, GA: Agency for Toxic Substances and Disease Registry (US). str. 22, 30. PMID 24049859. Pristupljeno 22. 11. 2015.
- ^ "Entrez gen: ALAD aminolevulinate, delta-, dehydratase".
- ^ ALA dehydratase reaction, from NetBiochem at the University of Utah. Last modified 1/5/95
- ^ a b Jaffe EK, Stith L (februar 2007). "ALAD porphyria is a conformational disease". American Journal of Human Genetics. 80 (2): 329–37. doi:10.1086/511444. PMC 1785348. PMID 17236137.
- ^ Overview of the Porphyrias Arhivirano 22. 7. 2011. na Wayback Machine at The Porphyrias Consortium (a part of NIH Rare Diseases Clinical Research Network (RDCRN)) Retrieved June 2011
Dopunska literatura[uredi | uredi izvor]
- Bernard A, Lauwerys R (1988). "Metal-induced alterations of delta-aminolevulinic acid dehydratase". Annals of the New York Academy of Sciences. 514: 41–7. doi:10.1111/j.1749-6632.1987.tb48759.x. PMID 3327436. S2CID 41966070.
- Jaffe EK (oktobar 2004). "The porphobilinogen synthase catalyzed reaction mechanism". Bioorganic Chemistry. 32 (5): 316–25. doi:10.1016/j.bioorg.2004.05.010. PMID 15381398.
- Roels HA, Buchet JP, Lauwerys RR, Sonnet J (august 1975). "Comparison of in vivo effect of inorganic lead and cadmium on glutathione reductase system and delta-aminolevulinate dehydratase in human erythrocytes". British Journal of Industrial Medicine. 32 (3): 181–92. doi:10.1136/oem.32.3.181. PMC 1008057. PMID 1156566.
- Ishida N, Fujita H, Fukuda Y, Noguchi T, Doss M, Kappas A, Sassa S (maj 1992). "Cloning and expression of the defective genes from a patient with delta-aminolevulinate dehydratase porphyria". The Journal of Clinical Investigation. 89 (5): 1431–7. doi:10.1172/JCI115732. PMC 443012. PMID 1569184.
- Dawson SJ, White LA (maj 1992). "Treatment of Haemophilus aphrophilus endocarditis with ciprofloxacin". The Journal of Infection. 24 (3): 317–20. doi:10.1016/S0163-4453(05)80037-4. PMID 1602151.
- Astrin KH, Kaya AH, Wetmur JG, Desnick RJ (august 1991). "RsaI polymorphism in the human delta-aminolevulinate dehydratase gene at 9q34". Nucleic Acids Research. 19 (15): 4307. doi:10.1093/nar/19.15.4307-a. PMC 328595. PMID 1678509.
- Wetmur JG, Kaya AH, Plewinska M, Desnick RJ (oktobar 1991). "Molecular characterization of the human delta-aminolevulinate dehydratase 2 (ALAD2) allele: implications for molecular screening of individuals for genetic susceptibility to lead poisoning". American Journal of Human Genetics. 49 (4): 757–63. PMC 1683158. PMID 1716854.
- Plewinska M, Thunell S, Holmberg L, Wetmur JG, Desnick RJ (juli 1991). "delta-Aminolevulinate dehydratase deficient porphyria: identification of the molecular lesions in a severely affected homozygote". American Journal of Human Genetics. 49 (1): 167–74. PMC 1683193. PMID 2063868.
- Potluri VR, Astrin KH, Wetmur JG, Bishop DF, Desnick RJ (juli 1987). "Human delta-aminolevulinate dehydratase: chromosomal localization to 9q34 by in situ hybridization". Human Genetics. 76 (3): 236–9. doi:10.1007/BF00283614. PMID 3036687. S2CID 32211471.
- Gibbs PN, Jordan PM (juni 1986). "Identification of lysine at the active site of human 5-aminolaevulinate dehydratase". The Biochemical Journal. 236 (2): 447–51. doi:10.1042/bj2360447. PMC 1146860. PMID 3092810.
- Wetmur JG, Bishop DF, Cantelmo C, Desnick RJ (oktobar 1986). "Human delta-aminolevulinate dehydratase: nucleotide sequence of a full-length cDNA clone". Proceedings of the National Academy of Sciences of the United States of America. 83 (20): 7703–7. Bibcode:1986PNAS...83.7703W. doi:10.1073/pnas.83.20.7703. PMC 386789. PMID 3463993.
- Wetmur JG, Bishop DF, Ostasiewicz L, Desnick RJ (1986). "Molecular cloning of a cDNA for human delta-aminolevulinate dehydratase". Gene. 43 (1–2): 123–30. doi:10.1016/0378-1119(86)90015-6. PMID 3758678.
- Doss M, von Tiepermann R, Schneider J (1981). "Acute hepatic porphyria syndrome with porphobilinogen synthase defect". The International Journal of Biochemistry. 12 (5–6): 823–6. doi:10.1016/0020-711X(80)90170-6. PMID 7450139.
- Kaya AH, Plewinska M, Wong DM, Desnick RJ, Wetmur JG (januar 1994). "Human delta-aminolevulinate dehydratase (ALAD) gene: structure and alternative splicing of the erythroid and housekeeping mRNAs". Genomics. 19 (2): 242–8. doi:10.1006/geno.1994.1054. PMID 8188255.
- Akagi R, Yasui Y, Harper P, Sassa S (septembar 1999). "A novel mutation of delta-aminolaevulinate dehydratase in a healthy child with 12% erythrocyte enzyme activity". British Journal of Haematology. 106 (4): 931–7. doi:10.1046/j.1365-2141.1999.01647.x. PMID 10519994. S2CID 24044521.
- Akagi R, Shimizu R, Furuyama K, Doss MO, Sassa S (mart 2000). "Novel molecular defects of the delta-aminolevulinate dehydratase gene in a patient with inherited acute hepatic porphyria". Hepatology. 31 (3): 704–8. doi:10.1002/hep.510310321. PMID 10706561. S2CID 8998084.
- Kervinen J, Jaffe EK, Stauffer F, Neier R, Wlodawer A, Zdanov A (juli 2001). "Mechanistic basis for suicide inactivation of porphobilinogen synthase by 4,7-dioxosebacic acid, an inhibitor that shows dramatic species selectivity". Biochemistry. 40 (28): 8227–36. CiteSeerX 10.1.1.374.9639. doi:10.1021/bi010656k. PMID 11444968.
Vanjski linkovi[uredi | uredi izvor]
- Lokacija ljudskog genoma ALAD i stranica sa detaljima o genu ALAD u UCSC Genome Browseru.
- delta-Aminolevulinic Acid Dehydratase na US National Library of Medicine Medical Subject Headings (MeSH)
- http://www.omim.org/entry/125270?search=pbgs&highlight=pbgs
Šablon:Porpfrinska biosinteza enzima Šablon:Lijaze ugljik-kisik