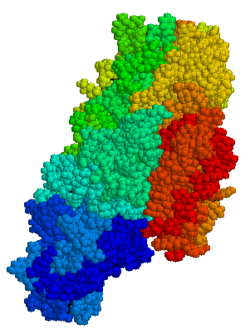
Tkivna transglutaminaza
| Protein-glutaminska gama-glutamiltransferaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||||
| EC broj | 2.3.2.13 | ||||||||
| CAS broj | 80146-85-6 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA unos | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG unos | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| PDB strukture | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologija gena | AmiGO / QuickGO | ||||||||
| |||||||||
Tkivna transglutaminaza (skraćeno tTG ili TG2) je kalcij ovisni enzim (EC 2.3.2.13) od 78-kDa, porodice protein-glutamin γ-glutamiltransferaza (ili jednostavno porodica transglutaminaza).[5][6] Kao i ostale transglutaminaze, umrežava proteine između ε-amino grupe ostatka lizina i γ-karboksamidne grupe ostatka glutamina, stvarajući inter– ili intramolekulskaa veza koja je vrlo otporna na proteolizu (razgradnju proteina). Osim funkcije umrežavanja, tTG katalizira i druge tipove reakcija, uključujući deamidaciju, vezivanje/hidrolizu GTP i aktivnosti izopeptidaza.[7] Za razliku od ostalih članova porodice transglutaminaza, tTG se može naći i u unutarćelijskim i u vanćelijskim prostorima različitih tipova tkiva, a nalazi se u mnogim različitim organima, uključujući srce, jetru i tanko crijevo. Unutaćelijski tTG obilan je u citosolu, ali manje količine mogu se naći i u jedru i mitohondrijama.[6] Smatra se da unutarćelijski tTG ima važnu ulogu u apoptozi.[8] U vanćelijskom prostoru, tTG se veže za proteine vanćelijskog matriksa (ECM), a[9] posebno se čvrsto veže za fibronektin.[10] Vanćelijski tTG povezan je sa adhezijom ćelija, stabilizacijom ECM-a, zacjeljivanjem rana, signalizacijom receptora, ćelijskokom proliferacijom i ćelijskom pokretljivošću.[6]
tTG je autoantigen u celijakiji, doživotnoj bolesti u kojoj konzumacija dijetetskog glutena uzrokuje patološki imunski odgovor koji rezultira upalom tankog crijeva i atrofijom crijevnih resica.[11][12][13] Također je uključen u patofiziologiju mnogih drugih bolesti, uključujući takve kao što su mnogi različiti karcinomi i neurogenerativne bolesti.[14]
Struktura[uredi | uredi izvor]
Gen[uredi | uredi izvor]
Ljudski gen tTG nalazi se na hromosomu 20 (pozicija 20q11.2-q12).
Protein[uredi | uredi izvor]
TG2 je multifunkcionalni enzim koji pripada transglutaminazama, koja kataliziraju umrežavanje proteina epsilon- (gama-glutamil) lizin-izopeptidnim vezama.[15] Slično kao i kod drugih transglutaminaza, tTG se sastoji od mjesta vezivanja za GTP/GDP, katalitske domene, dva beta-barel i beta-sendviča.[16] Kristalne strukture TG2 sa vezanim GDP, GTP ili ATP pokazale su da ovi oblici TG2 usvajaju "zatvorenu" konformaciju, dok TG2 s aktivnim mjestom koje zauzima inhibitorni imitirajući glutenski peptid ili drugi slični inhibitori prihvata "otvorenu" konformaciju.[17][18][19] U otvorenoj konformaciji, četiri domena TG2 raspoređena su u proširenoj konfiguraciji, omogućavajući katalitsku aktivnost, dok su u zatvorenoj konformaciji dva C-terminalna domena presavijena na katalitskom jezgru koje uključuje ostatak Cys-277.[20] N-terminalni domen eksprimira samo manje strukturne promjene između dvije različite konformacije.[21]
Mehanizam[uredi | uredi izvor]
Katalitski mehanizam za umrežavanje u ljudskom tTG uključuje tiolnu grupu iz ostatka Cys na aktivnom mestu tTG.[6] Tiol grupa napada karboksamidne ostatke glutamina na površina proteinskog ili peptidnog supstrata, oslobađajući amonijak i proizvodeći tioesterski međuprodukt. Intermedijer tioestera tada može napadati površinski amin drugog supstrata (obično iz lizinskog ostatka). Krajnji produkt reakcije je stabilna izopeptidna veza između dva supstrata (tj. umrežavanje). Alternativno, međuprodukt tioestera može se hidrolizirati, što rezultira neto konverzijom ostataka glutamina u glutaminsku kiselinu (tj. deamidaciju).[6] Smatra se da je deamidacija ostataka glutamina katalizirana tTG povezana sa patološkim imunskimi odgovorom na gluten kod celijakije.[12] Šema za umrežavanje i reakcije deamidacije data je na slici 1.

Regulacija[uredi | uredi izvor]
Ekspresija tTG regulirana je na nivou transkripcije, ovisno o složenosti kaskade signala. Jednom sintetizirani, većina proteina nalazi se u citoplazmi, plazmamembrani i ECM-u, ali se mali dio premješta u ćelijsko jedro, gdje sudjeluje u kontroli vlastite ekspresije, regulacijom faktora transkripcije.[22]
Umrežavanje aktivnosti tTG zahtijeva vezivanje Ca2+ iona.[23] Višestruki Ca2+ može se vezati za jednu molekulu tTG.[6] Tačnije, tTG veže do šest iona kalcija na pet različitih mjesta vezivanja. Mutacije na ovim vezivnim mjestima uzrokujući manji afinitet kalcija, smanjuju transglutaminaznu aktivnost enzima.[14] Suprotno tome, vezivanje jedne molekule GTP ili GDP inhibira aktivnost umrežavanja enzima.[23] Zato je unutarćelijski tTG uglavnom neaktivan zbog relativno visoke koncentracije GTP/GDP i niskog nivoa kalcija unutar ćelije.[6][12] Iako se očekuje da će vanćelijski tTG biti aktivan zbog niske koncentracija guaninskih nukleotida i visoki nivoi kalcija u vanćelijskom prostoru, a dokazi su pokazali da je vanćelijski tTG uglavnom neaktivan.[6][12][23] Nedavne studije sugeriraju da se vanćelijski tTG drži neaktivnim, formiranjem disulfidne veze između dva vitalna cisteinska ostatka, Cys 370 i Cys 371.[24] Kada se ta disulfidna veza formira, enzim ostaje u otvorenoj konformaciji, ali postaje katalitski neaktivan.[24] Oksidacija/redukcija disulfidne veze služi kao treći alosterni regulatorni mehanizam (zajedno sa GTP / GDP i Ca2+) za aktivaciju tTG. Pokazano je da [12] tioredoksin-1 aktivira vanćelijski tTG smanjenjem disulfidnih veza.[23] U tTG može nastati još jedna disulfidna veza, između ostataka Cys-230 i Cys-370. Iako ta veza ne postoji u izvornom stanju enzima, pojavljuje se kada se enzim oksidacijom inaktivira.[20] Prisustvo kalcija štiti od stvaranja obje disulfidne veze, što enzim čini otpornijim do oksidacije.[20]

Nedavna istraživanja sugeriraju da interferon-γ može služiti kao aktivator vanćelijskog tTG u tankom crijevu; ove studije imaju direktnu implikaciju na patogenezu celijakije.[12] Pokazalo se da je aktivacija tTG praćena velikim konformacijskim promjenama, prelazeći sa kompaktne (neaktivne) na proširenu (aktivnu) konformaciju (vidi sliku 3)[17][23][25]

Kompaktne (neaktivne) i proširene (aktivne) konformacije tTG
U vanćelijskom matriksu, TG2 je "isključen", prvenstveno zbog oksidacijske aktivnosti proteina endoplazmatskog retikuluma 57 (ERp57).[24] Dakle, tTG je alosterno reguliran sa dva odvojena proteina, Erp57 i TRX-1.[24] (vidi sliku 4).

Funkcija[uredi | uredi izvor]
tTG se svugdje eksprimira i prisutan je u različitim ćelijskim odjeljcima, kao što su citosol, ćelijsko jdro i plazmamembrana.[14] Kao kofaktor, potreban mu je kalcij za transamidaciju aktivnost. Transkripcija je povećana za retinojnu kiselinu. Između mnogih svojih pretpostavljenih funkcija, čini se da ima ulogu u zacjeljivanju rana, apoptozi i razvoju vanćelijskog matriksa [11], kao i diferencijacija i adhezija ćelije.[14] Primijećeno je da tTG može imati vrlo različitu aktivnost u različitim tipovima ćelija. Naprimjer, u neuronima, tTG podržava preživljavanje ćelija podvrgnutih ozljedama, dok je u astrocitima noktatiranje ekspresije gena za tTG korisnog za preživljavanje ćelija.[26]
Smatra se da je tTG uključen u regulaciju citoskeleta, križanjem različitih citoskeletnih proteina, uključujući miozin, aktin i spektrin.[27] Dokazi pokazuju da se unutarćelijski tTG umrežava sa miozinom. Također se vjeruje da tTG može stabilizirati strukturu umirućih ćelija tokom apoptoze, polimerizacijom komponenata citoskeleta, čime se sprečava isticanje ćelijskog sadržaja u vanćelijski prostor.[7]
tTG također ima aktivnost GTPaza:[5] U prisustvu GTP-a predloženo je da funkcionira kao G-protein koji učestvuje u signalnim procesima.[28] Pored transglutaminazne aktivnosti, predlaže se da tTG djeluje i kao kinaza,[29] proteinska disulfid-izomeraza,[30] i deamidaza.[31] Ova potonja aktivnost je važna u deamidaciji gliadinskih peptida, imajući tako važnu ulogu u patologiji celijakije.
tTG također ispoljava aktivnost PDI (protein-disulfid-izomeraza).[32][33] Na osnovu svoje PDI aktivnosti, tTG ima važnu ulogu u regulaciji proteostaze, katalizirajući trimerizaciju HSF1 (faktor toplotnog šoka 1), a time i reakciju tijela na toplotni šok. U odsustvu tTG, odgovor na toplotni šok je oslabljen. jer nije formiran potrebni trimer.[33]
Klinički značaj[uredi | uredi izvor]
tTG je najopsežnije proučavana transglutaminaza i povezan je s mnogim bolestima. Međutim, nijedna od ovih bolesti nije povezana sa nedostatkom enzima. Do sada nijedna bolest nije pripisana nedostatku aktivnosti tTG, a to je potvrđeno proučavanjem tTG nokaut miševa.[34]
Celijakija[uredi | uredi izvor]
tTG je najpoznatiji po svojoj povezanosti sa celijakijom.[13] Prvi put je povezan sa celijakijom 1997., kada je utvrđeno da je enzim antigen, prepoznat od antitijela, specifičnih za celijakiju.[34] Antitijela protiv transglutaminaze rezultiraju oblikom osjetljivosti na gluten, u kojem ćelijski odgovor na Triticeae glutene koji su umreženi na tTG, a u stanju su stimulirati transglutaminazne specifične B-ćelijske odgovore koji na kraju rezultiraju stvaranjem antitijela na transglutaminazu IgA i IgG.[35][36] tTG specifično deamidira glutaminske ostatke, stvarajući epitope koji povećavaju afinitet vezivanja glutenskih peptida za antigen koji predstavlja T-ćelije, pokrećući adaptivni imunski odgovor.[34]
Kancer[uredi | uredi izvor]
Nedavna istraživanja sugeriraju da tTG također ima ulogu u upalama i biologiji tumora.[11] Ekspresija tTG povišena je u više tipova ćelija karcinoma i implicirana je u rezistenciji na lijekove i metastazama, zbog sposobnosti da promoviraju mezenhimsku tranziciju i svojstva poput matičnih ćelija. U svom GTP vezanom obliku, tTG doprinosi preživljavanju ćelija karcinoma i čini se da je pokretač raka. tTG je pojačano reguliran u ćelijama i tkivima karcinoma kod mnogih tipova karcinoma, uključujući leukemiju, rak dojke, rak prostate, rak gušterače i rak grlića materice. Veća ekspresija tTG također korelira sa višim slučajevima metastaza, rezistencija na hemoterapiju, nižim stopama preživljavanja i općenito lošom prognozom. Ćelije raka mogu se ubiti povećanjem nivoa kalcija, aktiviranjem aktivnosti transamidacije tTG. Pretkliničko ispitivanje pokazalo je obećavajuće nalaze u korišćenju inhibitora tTG kao terapijskih sredstava protiv raka.[37] Međutim, druge studije [32] zabilježile su da bi aktivnost transamidacije tTG mogla biti povezana s inhibicijom invazivnosti tumorskih ćelija.
Ostale bolesti[uredi | uredi izvor]
Smatra se da tTG doprinosi u pojavi nekoliko neurodegenerativnih poremećaja, uključujući Alzhemerovu, Parkinsonovu i Huntingtonovu bolest, utičući na transkripciju, diferencijaciju, migraciju i adheziju.[38][39] Takve neurološke bolesti djelimično karakterizira abnormalna agregacija proteina, zbog povećane aktivnosti umrežavanja proteina u zahvaćenom mozgu.[40] Pored toga, specifični proteini povezani s ovim poremećajima utvrđeno je na supstratima tTG in vivo i in vitro.[7] Iako je tTG reguliran u područjima mozga pogođenih Huntingtonovom bolešću, nedavno istraživanje pokazalo je da povećani nivo tTG ne utiče na pojavu i/ili napredovanje bolesti kod miševa.[41]
Nedavna istraživanja pokazuju da tTG možda nije uključen u AD, jer studije pokazuju da je povezan s lizom eritrocita i da je posljedica bolesti, a ne uzrok. tTG je također povezan s patogenezom fibroze u različitim organima, uključujući pluća i bubreg. Konkretno, kod fibroze bubrega, tTG doprinosi stabilizaciji i akumulaciji ECM-a koji utiče na aktivnost TGF beta.[16]
Dijagnostika[uredi | uredi izvor]
Serologija za anti-tTG antitijela je zamijenila starije serološke testove (anti-endomizij, anti-gliadin i anti-retikulin) i ima jaku osetljivost ( 99%) i specifičnost (> 90%) za identifikaciju celijakije. Savremeni testovi za anti-tTG oslanjaju se na ljudski rekombinantni protein kao antigen.[42]
Terapeutika[uredi | uredi izvor]
Još se tTG eksperimentalno koristi kao oblik hirurškog ljepila. Takođe se proučava kao atenuator metastaza u određenim tumorima.[11] tTG pokazuje obećavajuće podatke kao potencijalni terapijski cilj za liječenje srčane fibroze, putem aktivnosti visoko selektivnOG tTG inhibitorA.[43] Pokazano je i da inhibitori tTG koče stvaranje toksičnih inkluzija, povezanih sa neurodegenerativnim bolestima.[44] To ukazuje da bi inhibitori tTG mogli poslužiti i kao alat za ublažavanje progresije bolesti povezanih s moždanim tTG.[44]
Interakcije[uredi | uredi izvor]
TG2 sudjeluje i u enzimima i u enzimskim interakcijama. Enzimske interakcije nastaju između TG2 i njegovih supstratnih proteina, koji sadrže glutaminski donor i lizin donorske grupe, u prisustvu kalcija. Poznato je da supstrati TG2 utjiču na aktivnost TG2, što mu omogućava da naknadno izvršava različite biološke funkcije u ćeliji. Međutim, značaj neenzimskih interakcija u regulaciji aktivnosti TG2 tek treba otkriti. Nedavna istraživanja pokazuju da neenzimske interakcije imaju fiziološke uloge i omogućavaju različite funkcije TG2 na način specifičan za kontekst.[45]
| Mišji mutantni aleli Tgm2-a | |
|---|---|
| Simbol markera za gen miša. Ovaj simbol je genomskom lokusu dodijelio MGI | Tgm2 |
| Klonovi matičnih ćelija mutiranog miša. To su poznate ciljane mutacije ovog gena u miša. | Tgm2tm1a(KOMP)Wtsi Arhivirano 22. 2. 2012. na Wayback Machine |
| Primjer strukture ciljanog uslovnog mutantnog alela za ovaj gen | |

| |
| Ove mutirane ES ćelije mogu se direktno proučavati ili koristiti za generiranje miševa s nokautiranim genom. Studija ovih miševa može rasvijetliti funkciju Tgm2: vidi Nokaut miš | |
Reference[uredi | uredi izvor]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000198959 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000037820 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Király R, Demény M, Fésüs L (decembar 2011). "Protein transamidation by transglutaminase 2 in cells: a disputed Ca2+-dependent action of a multifunctional protein". The FEBS Journal. 278 (24): 4717–39. doi:10.1111/j.1742-4658.2011.08345.x. PMID 21902809. S2CID 19217277.
- ^ a b c d e f g h Klöck C, Diraimondo TR, Khosla C (juli 2012). "Role of transglutaminase 2 in celiac disease pathogenesis". Seminars in Immunopathology. 34 (4): 513–22. doi:10.1007/s00281-012-0305-0. PMC 3712867. PMID 22437759.
- ^ a b c Facchiano F, Facchiano A, Facchiano AM (maj 2006). "The role of transglutaminase-2 and its substrates in human diseases". Frontiers in Bioscience. 11: 1758–73. doi:10.2741/1921. PMID 16368554.
- ^ McConkey DJ, Orrenius S (oktobar 1997). "The role of calcium in the regulation of apoptosis". Biochemical and Biophysical Research Communications. 239 (2): 357–66. CiteSeerX 10.1.1.483.2738. doi:10.1006/bbrc.1997.7409. PMID 9344835.
- ^ Lortat-Jacob H, Burhan I, Scarpellini A, Thomas A, Imberty A, Vivès RR, Johnson T, Gutierrez A, Verderio EA (maj 2012). "Transglutaminase-2 interaction with heparin: identification of a heparin binding site that regulates cell adhesion to fibronectin-transglutaminase-2 matrix". The Journal of Biological Chemistry. 287 (22): 18005–17. doi:10.1074/jbc.M111.337089. PMC 3365763. PMID 22442151.
- ^ Akimov SS, Krylov D, Fleischman LF, Belkin AM (februar 2000). "Tissue transglutaminase is an integrin-binding adhesion coreceptor for fibronectin". The Journal of Cell Biology. 148 (4): 825–38. doi:10.1083/jcb.148.4.825. PMC 2169362. PMID 10684262.
- ^ a b c d Griffin M, Casadio R, Bergamini CM (decembar 2002). "Transglutaminases: nature's biological glues". The Biochemical Journal. 368 (Pt 2): 377–96. doi:10.1042/BJ20021234. PMC 1223021. PMID 12366374.
- ^ a b c d e f Diraimondo TR, Klöck C, Khosla C (april 2012). "Interferon-γ activates transglutaminase 2 via a phosphatidylinositol-3-kinase-dependent pathway: implications for celiac sprue therapy". The Journal of Pharmacology and Experimental Therapeutics. 341 (1): 104–14. doi:10.1124/jpet.111.187385. PMC 3310700. PMID 22228808.
- ^ a b Di Sabatino A, Vanoli A, Giuffrida P, Luinetti O, Solcia E, Corazza GR (august 2012). "The function of tissue transglutaminase in celiac disease". Autoimmunity Reviews. 11 (10): 746–53. doi:10.1016/j.autrev.2012.01.007. PMID 22326684.
- ^ a b c d Király R, Csosz E, Kurtán T, Antus S, Szigeti K, Simon-Vecsei Z, Korponay-Szabó IR, Keresztessy Z, Fésüs L (decembar 2009). "Functional significance of five noncanonical Ca2+-binding sites of human transglutaminase 2 characterized by site-directed mutagenesis". The FEBS Journal. 276 (23): 7083–96. doi:10.1111/j.1742-4658.2009.07420.x. PMID 19878304. S2CID 21883387.
- ^ "Entrez Gene: TGM2 transglutaminase 2".
- ^ a b Hitomi K, Kojima S, Fesus L (2015). Transglutaminases : multiple functional modifiers and targets for new drug discovery. Tokyo. ISBN 9784431558255. OCLC 937392418.
- ^ a b Pinkas DM, Strop P, Brunger AT, Khosla C (decembar 2007). "Transglutaminase 2 undergoes a large conformational change upon activation". PLOS Biology. 5 (12): e327. doi:10.1371/journal.pbio.0050327. PMC 2140088. PMID 18092889.
- ^ Liu S, Cerione RA, Clardy J (mart 2002). "Structural basis for the guanine nucleotide-binding activity of tissue transglutaminase and its regulation of transamidation activity". Proceedings of the National Academy of Sciences of the United States of America. 99 (5): 2743–7. Bibcode:2002PNAS...99.2743L. doi:10.1073/pnas.042454899. PMC 122418. PMID 11867708.
- ^ Han BG, Cho JW, Cho YD, Jeong KC, Kim SY, Lee BI (august 2010). "Crystal structure of human transglutaminase 2 in complex with adenosine triphosphate". International Journal of Biological Macromolecules. 47 (2): 190–5. doi:10.1016/j.ijbiomac.2010.04.023. PMID 20450932.
- ^ a b c Stamnaes J, Pinkas DM, Fleckenstein B, Khosla C, Sollid LM (august 2010). "Redox regulation of transglutaminase 2 activity". The Journal of Biological Chemistry. 285 (33): 25402–9. doi:10.1074/jbc.M109.097162. PMC 2919103. PMID 20547769.
- ^ Chen X, Hnida K, Graewert MA, Andersen JT, Iversen R, Tuukkanen A, Svergun D, Sollid LM (august 2015). "Structural Basis for Antigen Recognition by Transglutaminase 2-specific Autoantibodies in Celiac Disease". The Journal of Biological Chemistry. 290 (35): 21365–75. doi:10.1074/jbc.M115.669895. PMC 4571865. PMID 26160175.
- ^ Bianchi N, Beninati S, Bergamini CM (maj 2018). "Spotlight on the transglutaminase 2 gene: a focus on genomic and transcriptional aspects" (PDF). The Biochemical Journal. 475 (9): 1643–1667. doi:10.1042/BCJ20170601. PMID 29764956.
- ^ a b c d e Jin X, Stamnaes J, Klöck C, DiRaimondo TR, Sollid LM, Khosla C (oktobar 2011). "Activation of extracellular transglutaminase 2 by thioredoxin". The Journal of Biological Chemistry. 286 (43): 37866–73. doi:10.1074/jbc.M111.287490. PMC 3199528. PMID 21908620.
- ^ a b c d Yi MC, Melkonian AV, Ousey JA, Khosla C (februar 2018). "Endoplasmic reticulum-resident protein 57 (ERp57) oxidatively inactivates human transglutaminase 2". The Journal of Biological Chemistry. 293 (8): 2640–2649. doi:10.1074/jbc.RA117.001382. PMC 5827427. PMID 29305423.
- ^ Colak G, Keillor JW, Johnson GV (januar 2011). Polymenis M (ured.). "Cytosolic guanine nucledotide binding deficient form of transglutaminase 2 (R580a) potentiates cell death in oxygen glucose deprivation". PLOS ONE. 6 (1): e16665. Bibcode:2011PLoSO...616665C. doi:10.1371/journal.pone.0016665. PMC 3031627. PMID 21304968.
- ^ Quinn BR, Yunes-Medina L, Johnson GV (juli 2018). "Transglutaminase 2: Friend or foe? The discordant role in neurons and astrocytes". Journal of Neuroscience Research. 96 (7): 1150–1158. doi:10.1002/jnr.24239. PMC 5980740. PMID 29570839.
- ^ Nurminskaya MV, Belkin AM (2012). Cellular functions of tissue transglutaminase. International Review of Cell and Molecular Biology. 294. str. 1–97. doi:10.1016/B978-0-12-394305-7.00001-X. ISBN 9780123943057. PMC 3746560. PMID 22364871.
- ^ Fesus L, Piacentini M (oktobar 2002). "Transglutaminase 2: an enigmatic enzyme with diverse functions". Trends in Biochemical Sciences. 27 (10): 534–9. doi:10.1016/S0968-0004(02)02182-5. PMID 12368090.
- ^ Mishra S, Murphy LJ (juni 2004). "Tissue transglutaminase has intrinsic kinase activity: identification of transglutaminase 2 as an insulin-like growth factor-binding protein-3 kinase". The Journal of Biological Chemistry. 279 (23): 23863–8. doi:10.1074/jbc.M311919200. PMID 15069073.
- ^ Hasegawa G, Suwa M, Ichikawa Y, Ohtsuka T, Kumagai S, Kikuchi M, Sato Y, Saito Y (august 2003). "A novel function of tissue-type transglutaminase: protein disulphide isomerase". The Biochemical Journal. 373 (Pt 3): 793–803. doi:10.1042/BJ20021084. PMC 1223550. PMID 12737632.
- ^ Sakly W, Thomas V, Quash G, El Alaoui S (decembar 2006). "A role for tissue transglutaminase in alpha-gliadin peptide cytotoxicity". Clinical and Experimental Immunology. 146 (3): 550–8. doi:10.1111/j.1365-2249.2006.03236.x. PMC 1810403. PMID 17100777.
- ^ a b Tabolacci C, De Martino A, Mischiati C, Feriotto G, Beninati S (januar 2019). "The Role of Tissue Transglutaminase in Cancer Cell Initiation, Survival and Progression". Medical Sciences. 7 (2): 19. doi:10.3390/medsci7020019. PMC 6409630. PMID 30691081.
- ^ a b Rossin F, Villella VR, D'Eletto M, Farrace MG, Esposito S, Ferrari E, Monzani R, Occhigrossi L, Pagliarini V, Sette C, Cozza G, Barlev NA, Falasca L, Fimia GM, Kroemer G, Raia V, Maiuri L, Piacentini M (juli 2018). "TG2 regulates the heat-shock response by the post-translational modification of HSF1". EMBO Reports. 19 (7): e45067. doi:10.15252/embr.201745067. PMC 6030705. PMID 29752334.
- ^ a b c Lorand L, Iismaa SE (januar 2019). "Transglutaminase diseases: from biochemistry to the bedside". FASEB Journal. 33 (1): 3–12. doi:10.1096/fj.201801544R. PMID 30593123. S2CID 58551851.
- ^ Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D (juli 1997). "Identification of tissue transglutaminase as the autoantigen of celiac disease". Nature Medicine. 3 (7): 797–801. doi:10.1038/nm0797-797. PMID 9212111. S2CID 20033968.
- ^ Murray JA, Frey MR, Oliva-Hemker M (juni 2018). "Celiac Disease". Gastroenterology. 154 (8): 2005–2008. doi:10.1053/j.gastro.2017.12.026. PMC 6203336. PMID 29550590.
- ^ Eckert, Richard L. (29. 1. 2019). "Transglutaminase 2 takes center stage as a cancer cell survival factor and therapy target: Transglutaminase in cancer". Molecular Carcinogenesis (jezik: engleski). 58 (6): 837–853. doi:10.1002/mc.22986. PMC 7754084. PMID 30693974. S2CID 59341070.
- ^ Wilhelmus MM, Verhaar R, Andringa G, Bol JG, Cras P, Shan L, Hoozemans JJ, Drukarch B (mart 2011). "Presence of tissue transglutaminase in granular endoplasmic reticulum is characteristic of melanized neurons in Parkinson's disease brain". Brain Pathology. 21 (2): 130–9. doi:10.1111/j.1750-3639.2010.00429.x. PMID 20731657. S2CID 586174.
- ^ Ricotta M, Iannuzzi M, Vivo GD, Gentile V (maj 2010). "Physio-pathological roles of transglutaminase-catalyzed reactions". World Journal of Biological Chemistry. 1 (5): 181–7. doi:10.4331/wjbc.v1.i5.181. PMC 3083958. PMID 21541002.
- ^ Martin A, Giuliano A, Collaro D, De Vivo G, Sedia C, Serretiello E, Gentile V (januar 2013). "Possible involvement of transglutaminase-catalyzed reactions in the physiopathology of neurodegenerative diseases". Amino Acids. 44 (1): 111–8. doi:10.1007/s00726-011-1081-1. PMID 21938398. S2CID 16143202.
- ^ Kumar A, Kneynsberg A, Tucholski J, Perry G, van Groen T, Detloff PJ, Lesort M (septembar 2012). "Tissue transglutaminase overexpression does not modify the disease phenotype of the R6/2 mouse model of Huntington's disease". Experimental Neurology. 237 (1): 78–89. doi:10.1016/j.expneurol.2012.05.015. PMC 3418489. PMID 22698685.
- ^ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, Not T (maj 2000). "Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease". The American Journal of Gastroenterology. 95 (5): 1253–7. PMID 10811336.
- ^ Wang Z, Stuckey DJ, Murdoch CE, Camelliti P, Lip GY, Griffin M (april 2018). "Cardiac fibrosis can be attenuated by blocking the activity of transglutaminase 2 using a selective small-molecule inhibitor". Cell Death & Disease. 9 (6): 613. doi:10.1038/s41419-018-0573-2. PMC 5966415. PMID 29795262.
- ^ a b Min B, Chung KC (januar 2018). "New insight into transglutaminase 2 and link to neurodegenerative diseases". BMB Reports. 51 (1): 5–13. doi:10.5483/BMBRep.2018.51.1.227. PMC 5796628. PMID 29187283.
- ^ Kanchan K, Fuxreiter M, Fésüs L (august 2015). "Physiological, pathological, and structural implications of non-enzymatic protein-protein interactions of the multifunctional human transglutaminase 2". Cellular and Molecular Life Sciences. 72 (16): 3009–35. doi:10.1007/s00018-015-1909-z. PMID 25943306. S2CID 14849506.
Vanjski linkovi[uredi | uredi izvor]
- Endomysial antibodies Arhivirano 12. 5. 2021. na Wayback Machine
- A collection of substrates and interaction partners of TG2 is accessible in the TRANSDAB, an interactive transglutaminase substrate database.