Kripton
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kripton u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Kripton, Kr, 36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Plemeniti gasovi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 18, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | bezbojan gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 1,9 · 10−9[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 83,798[2] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | (88) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 116 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Ar]3d10 4s24p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 1350,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 2350,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 3565 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. energija ionizacije | 5070 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. energija ionizacije | 6240 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. energija ionizacije | 7570 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. energija ionizacije | 10710 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8. energija ionizacije | 12138 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | gasovito | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubična prostorno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 3,7491[3] kg/m3 pri 273 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | dijamagnetičan (= −1,6 · 10−8)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 115,79 K (-157,36 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 121,2[5] K (-152 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | (čvrsti) 27,99 · 10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 9,03[5] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 1,64 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 10000 Pa pri 99 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 1120 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 0,00949 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 3,00[6][7] (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oznake upozorenja
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: nema oznaka upozorenja R S: nema oznake upozorenja S | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kripton (grčki: κρυφτος - sakriven) jeste hemijski element sa simbolom Kr i rednim brojem 36. U periodnom sistemu, on se nalazi u 8. glavnoj grupi odnosno 18. grupi po IUPAC-u i stoga se ubraja u plemenite gasove. Kao i drugi plemeniti gasovi, on je također bezbojni, izrazito nereaktivni jednoatomni gas. Po mnogim osobinama, poput tačke topljenja, ključanja i gustoće, kripton se nalazi između lakšeg argona i težeg ksenona. Kripton se ubraja među elemente koji su najrjeđi na Zemlji, a u njenoj atmosferi se nalazi samo u tragovima. Ovaj element su 1898. otkrili William Ramsay i Morris William Travers pomoću frakcione destilacije tečnog zraka. Zbog svoje rijetkosti se vrlo malo koristi, prvenstveno kao gas za punjenje svjetiljki. Poznat je vrlo mali broj spojeva kriptona, među kojima je kripton-difluorid, poznat kao jedno od najjačih oksidacijskih sredstava.
Historija[uredi | uredi izvor]

Nakon što su John William Strutt, 3. baron od Rayleigha i William Ramsay 1894. otkrili argon kao prvi plemeniti gas, te helij 1895. kojeg je Ramsay izolirao iz ruda uranija, a koji je do tada bio poznat samo iz Sunčevog spektra, on je na osnovu zakonitosti periodnog sistema uočio da bi trebao postojati još neki sličan element. Ramsay je počev do 1896. istraživao različite minerale i meteorite kao i gasove koje oni ispuštaju pri zagrijavanju ili rastvaranju. Međutim, njegov saradnik Morris William Travers i on nisu bili uspješni, pa su do tada uspjeli pronaći samo helij i rijetki argon. Također, ni proučavanja vrelih gasova iz Cauteretsa u Francuskoj i sa Islanda nisu dala nikakve rezultate.[8]
Naposlijetku, oni su počeli proučavati 15 litara sirovog argona kojeg su dobili te ga razdvajati na sastojke pomoću ukapljavanja i frakcione destilacije. Kada su ispitali nečistoće, koje su preostale nakon što je gotovo sav sirovi argon potpuno ispario, našli su do tada nepoznate žute i zelene spektralne linije tj. dokaz novog hemijskog elementa. Dali su mu ime kripton prema starogrčkom κρυπτός (kriptos) u značenju sakriven. Nakon što su Ramsay i Travers izvršili daljnju destilaciju i pročišćavanje, uspjeli su odrediti i molarnu masu kriptona od oko 80 g/mol. Poslije otkrića kriptona, a nakon što su iz jedne frakcije sa još nižom temperaturom ključanja izdvojiti gas neon, konačno su putem izdvajanja iz sirovog kriptona došli do još jednog plemenitog gasa, ksenona.[8]
A. von Antropoff je 1924. objavio da je uspio sintetizirati prvi spoj kriptona u obliku crvene, stabilne čvrste stvari sastavljene iz kriptona i hlora. Kasnije se ispostavilo da se u ovom spoju ne nalazi kripton već dušik-monoksid i hlorovodik. Ipak nakon 1962. kada je dobijen prvi spoj jednog plemenitog gasa, ksenona, počeo je veće interesovanje nauke i nastojanja da se sintetiziraju spojevi kriptona. Prvi takav spoj dobio je A.V. Grosse, za koji je prvobitno pretpostavljao da se radi o kripton-tetrafluoridu, da bi poslije dodatnih ispitivanja identificiran kao kripton-difluorid.[9]
Talasne dužine elektromagnetskog zračenja kojeg emitira izotop kriptona 86Kr uzet je 1960. kao osnova za definiciju jedinice metra. Time je ukinuto nedovoljno tačna definicija koja je do tada uzimana kao etalon "prametra" napravljen od legure iridija i platine. Tada je za jedan metar uzeta udaljenost 1.650.763,73 talasnih dužina elektromagnetnog zračenja nuklida 86Kr koje emitira pri prelasku iz stanja 5d5 u 2pl0 u vakuumu.[10] Ova definicija je važila sve do 1983. kada je zamijenjena definicijom, koja se uzima kao udaljenost koju svjetlost pređe u vakuumu za određeni dio sekunde.[11]
Osobine[uredi | uredi izvor]
Fizičke[uredi | uredi izvor]
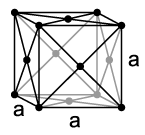
U normalnim uslovima temperature i pritiska, kripton je jednoatomni, bezbojni gas bez mirisa, koji se kondenzira pri temperaturi od 121,2 K (−152 °C) a pri 115,79 K (−157,36 °C) prelazi u čvrsto stanje. Kao i drugi plemeniti gasovi osim helija, kripton se kristalizira u kubičnom gusto pakovanom kristalnom sistemu sa parametrom rešetke a = 572 pm.[12] Kao i svi plemeniti gasovi, on također ima sve elektronske ljuske popunjene (elektronska konfiguracija plemenitog gasa). Time se može objasiti da se kao gas nalazi u jednoatomnom stanju, te da mu je reaktivnost izuzetno slaba.
Sa gustoćom od 3,749 kg/m³ pri temperaturi od 0 °C i pritisku od 1013 hPa, kripton je teži od zraka i pada na tlo. U faznom dijagramu, trojna tačka se nalazi na 115,76 K und 0,7315 bar,[13] dok se kritična tačka nalazi na −63,75 °C, 5,5 MPa pri čemu je kritična gustoća 0,909 g/cm³.[14] U vodi je slabo rastvorljiv, tako da se pri 0 °C u 1 litru vode može rastvoriti najviše 110 ml kriptona.[14]
Hemijske[uredi | uredi izvor]
Poput svih plemenitih gasova, kripton je veoma nereaktivan. U izuzetnim slučajevima i pod posebnim uslovima okruženja, on može reagirati sa najelektronegativnijim elementom, fluorom, pri čemu nastaje kripton-difluorid. Za razliku od ksenon-fluorida, kripton-difluorid je termodinamički nestabilan, njegovo stvaranje je stoga endotermno te se mora odvijati pri nižim temperaturama. Fluorovi radikali, koji su neophodni za reakciju sa kriptonom, mogu se dobiti pomoću zračenja ultraljubičastim zrakama, bombardiranjem protonima ili električnim pražnjenjem.[9]
Kripton gradi klatrate sa različitim spojevima, u kojima je gas fizički zatvoren u neku šupljinu te je na taj način vezan za njih. Tako naprimjer kripton sa vodom i smjesom vode i hloroforma gradi klatrat pri −78 °C,[15] dok je klatrat sa hidrohinonom tako stabilan da je kripton za njega vezan duže vrijeme.[14] Također je poznat i inkluzijski spoj kriptona u oligosaharidu α-ciklodekstrinu.[16]
Izotopi[uredi | uredi izvor]
Poznat je ukupno 31 izotop kriptona te 10 nuklearnih izomera. Među njima postoji pet stabilnih izotopa: 80Kr, 82Kr, 83Kr, 84Kr i 86Kr. Svi oni se javljaju u prirodi kao i izotop 78Kr koji se vrlo sporo raspada (vrijeme poluraspada 2 · 1021 godina). Najveći udio u prirodnoj smjesi izotopa ima izotop 84Kr sa 57 %, a slijede ga 86Kr sa 17,3 %; 82Kr sa 11,58 % i 83Kr sa 11,49 %. Osim ovih, izotop 80Kr sa udjelom od 2,28% i 78Kr sa 0,35% su mnogo rjeđi u prirodi.[17] U prirodi se također nalazi i radioaktivni izotop kriptona 81Kr, koji je ujedno i njegov najduže živući nestabilni izotop sa vremenom poluraspada od 229 hiljada godina,[17] a nastaje u tragovima putem atmosferskih reakcija.[18] I radioaktivni izotop 85Kr sa vremenom poluraspada od 10,756 godina također se javlja u atmosferi u tragovima. On nastaje zajedno sa drugim kratkoživućim izotopima pri razbijanju jezgara uranija i plutonija. Može dospjeti u atmosferu bilo nuklearnom eksplozijom ili tokom ponovne prerade nuklearnog goriva, a zbog različite raspodjele emisijskih izvora na Zemlji mnogo je češći na sjevernoj nego na južnoj hemisferi. Nakon atmosferskih nuklearnih testova 1960tih i značajnog zagađenja atmosfere izotopom 85Kr, uslijedio je pad njegove koncentracije,[18] ali je na mjernoj stanici u Gentu između 1979. i 1999. zabilježen nagli porast zbog rada postrojenja za ponovnu preradu nuklearnog goriva u La Hague u Normandiji.[19] Stabilni izotop 83Kr je jedini NRM-aktivni izotop kriptona. Hiperpolarizirani 83Kr je korišten u testovima na pacovima za proučavanje pluća životinja pomoću tomografije magnetnom rezonancom.[20]
Rasprostranjenost[uredi | uredi izvor]
Kripton se ubraja među najrjeđe elemente na Zemlji. Smatra se da su od njega rjeđi samo ksenon i neki radioaktivni elementi, koji se u prirodi nalaze najvećim dijelom već raspadnuti poput plutonija ili kao kratkoživući međuproizvodi u nekom od lanaca raspada. Udio kriptona u Zemljinoj kori iznosi 1,9 × 10−5 ppm,[1] dok se najveći dio ovog gasa nalazi u atmosferi, u kojoj ga ima oko 1,14 ppm.[21]
U svemiru je kripton daleko češći, a njegova raspostranjenost uporediva je sa litijem, galijem ili skandijem.[22] Odnos između kriptona i vodika u svemiru je općenito konstantan. Iz toga se mogu izvući zaključak da je međuzvjezdana materijal bogata kriptonom.[23] Prisustvo ovog gasa je dokazano i u jednom bijelom patuljku. Pri tome je izmjerena količina kriptona oko 450 puta veća nego u Suncu, a razlog velikog udjela tog gasa nije poznat.[24]
Dobijanje[uredi | uredi izvor]
Dobijanje kriptona se vrši isključivo u okvirima Lindeovog postupka izdvajanjem iz zraka. Pri razdvajanju dušika i kisika, kripton se obogaćuje tj. koncentrira u tečnom kisiku zbog velike gustoće, zajedno sa ksenonom na dnu destilacijske kolone. Ta smjesa se prevodi u narednu kolonu u kojoj se koncentracije kriptona i ksenona povećavaju do 0,3%.[25] Ona pored tečnog kisika i koncentrata ksenona i kriptona sadrži još velike količine ugljikovodika poput metana, fluoriranih spojeva poput sumpor-heksafluorida ili tetrafluormetana kao i tragove ugljik-dioksida i didušik-monoksida. Metan i didušik-monoksid se mogu prevesti u ugljik-dioksid, vodu i dušik pomoću sagorijevanja na platinskim ili paladijskim katalizatorima na 500 °C, te se adsorpcijom na molekularnom situ mogu ukloniti.[26]
Međutim, iz ove smjese na ovaj način se ne mogu izdvojiti spojevi fluora. Da bi se oni razložili i uklonili iz smjese, gas se može ozračiti mikrotalasima pri čemu pucaju veze između elementa i fluora a slobodni atomi fluora mogu se uhvatiti u natron-krečom (smjesa natrij- i kalcij-hidroksida)[27] ili ih prevoditi preko katalizatora od titanij-dioksid-cirkonij-dioksida na temperaturi od 750 °C. U tom procesu fluorovi spojevi reagiraju do ugljik-dioksida i fluorovodika i drugih spojeva, pa se mogu lahko izdvojiti.[26]
Konačno, smjesa kriptona i ksenona se uvodi u sljedeću kolonu, koja se s gornje strane hladi a s donje zagrijava, gdje se razdvajaju. Ksenon se nakuplja na dnu, dok se prema vrhu kolone formira struja gasa, kojom prvo odlazi kisik, a nakon nekog vremena i kripton. Oksidacijom se kripton oslobađa zaostalih tragova kisika te se sakuplja i pakuje u boce.[25]
Upotreba[uredi | uredi izvor]

Najveći dio proizvodnje kriptona koristi se za punjenje svjetiljki s lučnim praženjenjem. Zbog njegove inertnosti, stepen isparavanja i oksidacije žarnih niti od volframa je znatno sporiji, što omogućava znatno višu temperaturu žarenja. Samim tim dobija se i mnogo viši stepen iskorištenja rada svjetiljke. Kripton ponekad ulazi i u sastav halogenih i fluorescentnih svjetiljki. Osim navedenog, on služi i kao gas za punjenje u Geigerovim brojačima, scintilacijskim brojačima i elektronskim uređajima.[25] I pored visoke cijene nerijetko se stavlja kao gas za izolaciju staklenih komora umjesto mnogo jeftinijeg argona, kada se pri istoj debljini staklene stijenke želi ostvariti znatno bolja izolacija bez obzira na troškove.
Zajedno sa fluorom, kripton se koristi u kripton-fluorid laserima. Ti laseri se ubrajaju u ekscimerne lasere a imaju talasne dužine od 248 nm u ultraljubičastom spektralnom području.[28] Također, laseri na bazi iona plemenitih gasova sadrže kripton, u kojima su aktivni medij jednostruko ili višestruko naelektrisani ioni kriptona.[29] Kao i ksenon, kripton također apsorbira rendgensko zračenje, mada u znatno manjoj mjeri. Stoga se ispituje da li se mješavina kriptona i ksenona može koristiti kao kontrastno sredstvo pri kompjuterskoj tomografiji (CT). Takva smjesa može dati bolji kontrast nego sâm ksenon, čiji udio u kontrastnom sredstvu je ograničen na najviše 35% zbog njegovog narkotičkog djelovanja na ljude.[30] Tečni kripton se koristi kao materijal za kalorimetriju u fizici čestica. On omogućava posebno tačno određivanje mjesta i energije.[31] Primjer detektora čestica, koji koristi kalorimetre na bazi tečnog kriptona, jeste eksperiment NA48 pri CERNu.[32]
Spojevi[uredi | uredi izvor]
Poznat je vrlo mali broj spojeva kriptona. Najstabilniji i najvažniji od njih je kripton-difluorid. On se ubraja među najsnažnija poznata oksidacijska i fluorizacijska sredstva a u mogućnosti je i oksidirati ksenon do ksenon-fluorida ili jod do jod-pentafluorida. Ako kripton-difluorid reagira sa nekim primaocem fluora poput antimon-pentafluorida, nastat će kationi KrF+ i Kr2F3+, koji su najsnažnija poznata oksidacijska sredstva.
Poznati su i spojevi sa drugim ligandima izuzev fluora. U njih se između ostalih ubrajaju kriptonbis(pentafluorortotelurat) Kr(OTeF5)2, koji je jedini poznati spoj kisika i kriptona, te RCNKrF+AsF6− (gdje je R=H, CF3, C2F5 ili n-C3F7) sa spojem kriptona i dušika i HKrCCH, gdje je kripton spojen na ligand etina.[33]
Reference[uredi | uredi izvor]
- ^ a b Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ^ IUPAC, Standard Atomic Weights Revised 2013
- ^ GESTIS[mrtav link] baza podataka supstanci
- ^ Weast, Robert C. (gl. ur.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. str. E-129 do E-145. ISBN 0-8493-0470-9.
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks, u: Journal of Chemical & Engineering Data. 56, 2011, str. 328–337, doi:10.1021/je1011086
- ^ L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases u: Journal of Inorganic and Nuclear Chemistry. 1980, 42, str. 1523–1524, doi:10.1016/0022-1902(80)80132-1
- ^ T. L. Meek: Electronegativities of the Noble Gases. u: Journal of chemical education. 1995, 72, str. 17–18.
- ^ a b William Ramsay: The Rare Gases of the Atmosphere. Govor tokom dodjele Nobelove nagrade 12. decembar 1904.
- ^ a b John F. Lehmann, Hélène P. A. Mercier, Gary J. Schrobilgen: The chemistry of krypton. u: Coordination Chemistry Reviews. 2002, 233/234, str. 1–39, doi:10.1016/S0010-8545(02)00202-3.
- ^ K. Clusius: Zur Geschichte des Metermasses. u: Cellular and Molecular Life Sciences. 1963, 19, 4, str. 169–177, doi:10.1007/BF02172293.
- ^ Međunarodni biro za mjere i utege: The BIPM and the evolution of the definition of the metre Arhivirano 7. 6. 2011. na Wayback Machine. Pristupljeno 10. decembra 2009.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica. 1974, 30, str. 193–204.
- ^ W. T. Ziegler, D. W. Yarbrough, J. C. Mullins: Calculation of the Vapor Pressure and Heats of Vaporization and Sublimation of Liquids and Solids below One Atmosphere Pressure. VI. Krypton. u: Ga. Inst. Technol., Eng. Exp. Stn., Proj. A-764, Tech. Rep. No. 1, 1964. (NIST webbook).
- ^ a b c Helmut Sitzmann: Krypton. Thieme Chemistry (izdavač): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 2011.
- ^ R. M. Barrer, D. J. Ruzicka: Non-stoichiometric clathrate compounds of water. Dio 4. – Kinetics of formation of clathrate phases. u: Transactions of the Faraday Society. 1962, 58, str. 2262–2271, doi:10.1039/TF9625802262.
- ^ Wolfram Saenger, Mathias Noltemeyer: Röntgen-Strukturanalyse des α-Cyclodextrin-Krypton-Einschlußkomplexes: Ein Edelgas in organischer Matrix. u: Angewandte Chemie. 1972, 86, 16, str. 594–595, doi:10.1002/ange.19740861611.
- ^ a b G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties Arhivirano 20. 7. 2011. na Wayback Machine (PDF). u: Nuclear Physics. 2003, vol. A 729, str. 3–128.
- ^ a b Dan Snyder: Resources on Isotopes – Periodic Table--Krypton Arhivirano 24. 9. 2001. na Wayback Machine. United States Geological Survey, stanje januar 2004.
- ^ P. Cauwels, J. Buysse, A. Poffijn, G. Eggermont: Study of the atmospheric 85Kr concentration growth in Gent between 1979 and 1999. u: Radiation Physics and Chemistry. 2001, 61, str. 649–651, doi:10.1016/S0969-806X(01)00361-9.
- ^ Zackary I. Cleveland, Galina E. Pavlovskaya, Nancy D. Elkins, Karl F. Stupic, John E. Repine, Thomas Meersmann: Hyperpolarized 83Kr MRI of lungs. u: Journal of Magnetic Resonance. 2008, 195, 2, str. 232–237, doi:10.1016/j.jmr.2008.09.020.
- ^ David R. Williams: Earth Fact Sheet. NASA, Greenbelt, stanje 20. maj 2009.
- ^ A. G. W. Cameron: Abundances of the elements in the solar system. u: Space Science Reviews, 1970, 15, str. 121–146; PDF.
- ^ Stefan I. B. Cartledge, J. T. Lauroesch, David M. Meyer, Ulysses J. Sofia, Geoffrey C. Clayton: Interstellar Krypton Abundances: The Detection of Kiloparsec-scale Differences in Galactic Nucleosynthetic History. u: The Astrophysical Journal. 2008, 687, str. 1043–1053, doi:10.1086/592132.
- ^ Klaus Werner, Thomas Rauch, Ellen Ringat, Jeffrey W. Kruk: First detection of Krypton and Xenon in a white dwarf. u: The Astrophysical Journal. 753, 2012, str. L7, doi:10.1088/2041-8205/753/1/L7.
- ^ a b c P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. u: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- ^ a b EP patent 1752417, Matthias Meilinger, "Process and apparatus for the production of krypton and/or xenon", izdan 20. 9. 2005, dodijeljen Linde AG
- ^ Jean-Christophe Rostaing, Francis Bryselbout, Michel Moisan, Jean-Claude Parenta: Méthode d’épuration des gaz rares au moyen de décharges électriques de haute fréquence. u: Comptes Rendus de l'Académie des Sciences – Series IV – Physics. 2000, 1, 1, str. 99–105, doi:10.1016/S1296-2147(00)70012-6.
- ^ Thomas H. Johnson, Allen M. Hunter: Physics of the krypton fluoride laser. u: J. Appl. Phys. 1980, 51, str. 2406–2420, doi:10.1063/1.328010.
- ^ Helmut Sitzmann: Edelgas-Ionen-Laser. Thieme Chemistry (izdavač): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 19. juni 2014.
- ^ Deokiee Chon, Kenneth C. Beck, Brett A. Simon, Hidenori Shikata, Osama I. Saba, Eric A. Hoffman: Effect of low-xenon and krypton supplementation on signal/noise of regional CT-based ventilation measurements. u: J. Appl. Physiol. 2007, 102, str. 1535–1544, doi:10.1152/japplphysiol.01235.2005.
- ^ V. M. Aulchenko, S. G. Klimenko, G. M. Kolachev, L. A. Leontiev, A. P. Onuchin, V. S. Panin, Yu. V. Pril, V. A. Rodyakin, A. V. Rylin, V. A. Tayursky et al.: Investigation of an electromagnetic calorimeter based on liquid krypton. u: Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 1990, 289, str. 468–474, doi:10.1016/0168-9002(90)91518-G.
- ^ E. Mazzucato: Status of the NA48 experiment at the CERN SPS. u: Nuclear Physics B – Proceedings Supplements. 1997, 59, str. 174–181, doi:10.1016/S0920-5632(97)00440-4.
- ^ Leonid Khriachtchev, Hanna Tanskanen, Arik Cohen, R. Benny Gerber, Jan Lundell, Mika Pettersson, Harri Kiljunen, Markku Räsänen: A Gate to Organokrypton Chemistry: HKrCCH. u: Journal of the American Chemical Society. 2003, 125, 23, str. 6876–6877, doi:10.1021/ja0355269.
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Kripton |
- Kripton[mrtav link] na stranici EnvironmentalChemistry.com
- Kripton u serijalu The Periodic Table of Videos (Univerzitet u Nottinghamu)


