Stroncij
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stroncij u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Stroncij, Sr, 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Zemnoalkalni metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 2, 5, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | Srebrnobijeli metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 0,014[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 87,62 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 200 (219) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 195 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | 249[2] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Kr] 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izlazni rad | 2,59[3] eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 549,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 1064,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubična plošno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 2630[4] kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | paramagnetičan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 1050 K (777 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 1653[5] K (1380 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 33,94 · 10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 141[5] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 246 Pa pri 1042 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 300 J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 7,41 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 35 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksid | SrO | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | -2,89 V (Sr2+ + 2e- → Sr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 0,95 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 15 S: 8-24/25-43 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Stroncij (latinski: ') jest hemijski element sa simbolom Sr i atomskim brojem 38. U periodnom sistemu elemenata nalazi se u petoj periodi i drugoj glavnoj grupi, pa tako pripada zemnoalkalnim metalima. On je mehki i veoma reaktivni metal. Po Mohsovoj skali ima tvrdoću 1,5.
Element je otkrio Adair Crawford 1790. i imenovao ga po mjestu Strontian u Škotskoj, gdje je i otkriven. S malim primjesama drugih elemenata, ali u prilično čistom elementarnom stanju, Humphry Davy dobio ga je 1808. u procesu elektrolize. Tek 1855. Robert Bunsen uspio je dobiti čisti stroncij. Danas se elementarni čisti stroncij upotrebljava još samo za izradu katodnih cijevi, u pirotehnici (zbog crvenog plamena), trajnim magnetima i pri topljenju aluminija.
U ljudskom tijelu ima ga u veoma malim količinama, ali nema nijednu poznatu biološku ulogu niti je neophodan. Nedavno se počelo istraživati o utjecaju stroncijevih soli, naročito stroncij-ranelata, za liječenje osteoporoze.[6]
Historija[uredi | uredi izvor]
Prve dokaze o postojanju ovog elementa našli su Adair Crawford i William Cumberland Cruikshank 1790. godine, kada su detaljnije proučili jedan mineral koji potječe iz sela Strontian iz Škotske. Dotad su taj mineral smatrali barij-karbonatom ili mineralom viteritom. Od minerala su načinili hlorid te su uspoređivali mnoge osobine barij-hlorida i novonastalog hlorida, kasnije poznatog kao stroncij-hlorid. Pritom su utvrdili da se hloridi razlikuju u rastvorljivosti u vodi, a različite su bile u forme kristala. Kasnije je Friedrich Gabriel Sulzer 1791. godine[7] novom mineralu dao ime stroncijanit po mjestu gdje je pronađen. Sulzer i Johann Friedrich Blumenbach još su preciznije proučavali mineral i pronašli i druge razlike u odnosu na viterit, kao što su različit stepen otrovnosti i boja plamena.[8] Sljedećih godina stroncijanit su detaljnije proučavali hemičari kao što su Martin Heinrich Klaproth, Richard Kirwan, Thomas Charles Hope i Johann Tobias Lowitz te su iz njega dobili druge spojeve stroncija.[9]
Humphry Davy uspio je 1808. dobiti stroncij u metalnom stanju elektrolitičkom redukcijom u prisustvu crvenog živa(II) oksida, čime je nastao amalgam, te ga je na kraju pročistio destilacijom. Tako dobijeni stroncij i dalje je sadržavao tragove drugih elemenata.[10] On ga je nazvao strontium po mineralu stroncijanitu, analogno drugim zemnoalkalnim metalima. Čisti elementarni stroncij dobio je Robert Bunsen 1855. elektrolizom istopljenog stroncij-hlorida. Također je utvrdio neke osobine metala stroncija kao što je gustoća.[11]
Osobine[uredi | uredi izvor]
Fizičke[uredi | uredi izvor]
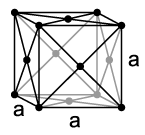
U potpuno čistom elementarnom stanju, stroncij je svijetli, zlatnožuti, sjajni metal[12], dok mu primjese drugih elemenata daju srebrnastobijeli izgled. U prisustvu zraka na njegovoj površini stvara se zaštitni sloj oksida, slično kao i kod aluminija. Po temperaturi topljenja od 777 °C i temperaturi ključanja od 1380 °C nalazi se između lahkog kalcija i težeg barija, tako da kalcij ima nešto više, a barij nešto niže talište. Nakon magnezija i radija stroncij ima najnižu tačku ključanja među zemnoalkalnim metalima. Ubraja se u lahke metale i ima gustoću 2,63 g/cm3. Vrlo je mehak – po Mohsovoj skali ima tvdoću 1,5 i može se lahko savijati i valjati. Poput kalcija, stroncij na sobnoj temperaturi se kristalizira u kubični plošno centrirani kristalni sistem, prostorna grupa Fmm (tip bakra) s parametrom rešetke a = 608,5 pm sa četiri formulske jedinice po elementarnoj ćeliji. Osim ove, poznate su još dvije modifikacije koje nastaju na visokim temperaturama. Na temperaturi višoj od 215 °C kristalna struktura mijenja se u heksagonalnu kompaktnu sferičnu strukturu (tip magnezija) s parametrima rešetke a = 432 pm i c = 706 pm. Iznad 605 °C najstabilnija je kubična prostorno centrirana struktura (tip volframa).[13]
Hemijske[uredi | uredi izvor]
Nakon barija i radija stroncij je najreaktivniji zemnoalkalni metal. Reagira s halogenim elementima, kisikom, dušikom i sumporom, gradeći okside, hidrokside, fluoride i soli organskih kiselina. U svim svojim spojevima uvijek gradi dvovalentne katione. Pri zagrijavanju na zraku sagorijeva dajući tipični jarkocrveni plamen, oksidirajući na stroncij-oksid i stroncij-nitrid. Kao veoma neplemenit (bazni metal), reagira s vodom istjerujući vodik i gradeći stroncij-hidroksid, koji se stvara već pri kontaktu metala s vlagom iz zraka. Stroncij se rastvara i u amonijaku, gradeći plavo-crni kompleks (amonijakat).
Izotopi[uredi | uredi izvor]
Poznata su 32 izotopa stroncija i sedam nuklearnih izomera, čije su atomske mase između 75 i 101. Od njih su stabilna četiri izotopa, koja se javljaju u prirodi: 84Sr, 86Sr, 87Sr i 88Sr. U prirodnoj smjesi izotopa prevladava izotop 88Sr s udjelom 82,58%. Izotopi 86Sr s udjelom 9,86%, 87Sr sa 7%, kao i 84Sr s udjelom 0,56% mnogo su rjeđi.[14] Izotop 90Sr emitira beta-zrake energijom raspada od 546 keV s vremenom poluraspada 28,78 godina, nakon čega prelazi u izotop 90Y, koji se dalje raspada (vrijeme poluraspada 64,1 sat), emitirajući energetski snažnije beta (energija raspada od 2282 keV) i gama-zrake, dajući stabilni izotop 90Zr. Pritom se 90Sr pojavljuje uglavnom kao sekundarni proizvod raspada. Nastaje u toku nekoliko minuta nakon višestrukog beta-raspada iz primarnih proizvoda raspada masenog broja 90, koji se javlja pri 5,7%[15] od svih nuklearnih raspada izotopa uranija 235U u nuklearnim reaktorima i pri eksploziji atomske bombe. Zbog toga se izotop 90Sr ubraja među najčešće proizvode raspada uopće.[16]
Kod svih dosadašnjih nuklearnih katastrofa u svijetu u okolinu su dospjele velike količine izotopa 90Sr. Nesreće uslijed kojih je u okolinu ispušten izotop 90Sr, između ostalih, jesu požar u nuklearnoj centrali Windscale 1957, kada je ispušteno 0,07 TBq 90Sr,[17] i Černobilska katastrofa, kad je ispuštena radioaktivnost 90Sr iznosila 800 TBq.[18] Nakon nadzemnih nuklearnih testova u periodu 1955–1958. te 1961-1963. izuzetno je porasla koncentracija 90Sr u atmosferi. To je dovelo, zajedno s povećanjem koncentracije izotopa 137Cs, do potpisivanja sporazuma o zabrani nuklearnih testova u atmosferi, svemiru i pod vodom 1963, kojim su takvi testovi zabranjeni svim državama potpisnicama. Nakon tog sporazuma primjetno je značajno smanjenje ispuštanja stroncijevog izotopa u atmosferu.[19] Ukupna količina ispuštene radioaktivnosti 90Sr u nuklearnim testovima iznosi približno 6×1017 Bq (600 PBq).[16]
Rasprostranjenost[uredi | uredi izvor]
Zastupljen je u kontinentalnom dijelu Zemljine kore u količini od 370 ppm,[20] što ga čini relativno dobro zastupljenim elementom – ima ga gotovo jednako kao i barija i sumpora. I u morskoj vodi nalaze se velike količine stroncija. U prirodi se ne može naći samorodan nego je prisutan samo u raznim spojevima. Uz vrlo slabu topljivost u vodi, najvažniji minerali stroncija jesu celestin (SrSO4), s udjelom stroncija do 47,7%,[21] kao i stroncij-karbonat, odnosno stroncijanit, s udjelom stroncija do 59,4%.[21] Do 2013. otkriveno je više od 200 minerala koji sadrže stroncij.[22]
Depoziti najvažnijeg minerala stroncija, celestina, nastali su taloženjem teško rastvorljivog stroncij-sulfata iz morske vode. Također je moguće i hidrotermalno stvaranje minerala. Stroncijanit se stvara iz celestina hidrotermalno, ali i kao sekundarni mineral. Najznačajnija nalazišta ruda stroncija jesu u Španiji, Meksiku, Turskoj, Kini i Iranu. Ujedinjeno Kraljevstvo dugo je bilo jedan od najvećih proizvođača stroncija, ali je prestalo s proizvodnjom 1992.[23] Svjetska potražnja za stroncijevim mineralima u 2008. iznosila je otprilike 496.000 tona.[24]
Dobijanje[uredi | uredi izvor]
Početni materijal za dobijanje metalnog stroncija i njegovih spojeva najčešće je celestin (stroncij-sulfat). Po pravilu, iz njega se prvo dobija stroncij-karbonat, koji je najvažniji industrijski spoj stroncija i osnova za industrijsku proizvodnju stroncija i njegovih spojeva.
Da bi se dobio stroncij-karbonat, stroncij-sulfat se zagrijava na 1100–1200 °C u prisustvu ugljika. Pritom se sulfat reducira na sulfid te nastaju stroncij-sulfid i ugljik-dioksid. Stroncij-sulfid se zatim prečišćava putem ekstrakcije vrelom vodom.[23]
Na kraju, kroz rastvor stroncij-sulfida uvodi se ugljik-dioksid ili se stroncij-sulfid zamjenjuje natrij-karbonatom. Pritom, osim stroncij-karbonata, nastaju vodik-sulfid, odnosno natrij-sulfid. Koja će od navedene dvije varijante biti korištena zavisi od dostupnosti potrebnih sirovina i mogućnosti prodaje međuproizvoda.[23]
Usitnjeni mljeveni stroncij-sulfat može se direktno pretvoriti u stroncij-karbonat djelovanjem natrij- ili amonij-karbonatom. Međutim, nakon toga su potrebne skupe procedure pročišćavanja. Da bi se dobio metalni stroncij, stroncij-oksid se reducira aluminijem (aluminotermija). Pritom, osim elementarnog stroncija, nastaje smjesa aluminij- i stroncij-oksida. Reakcija se odvija u vakuumu, a pri tim uvjetima stroncij može reagirati u plinovitom stanju, te ga je takvog lahko odvojiti u uređaju za hlađenje.[23]
Upotreba[uredi | uredi izvor]

Stroncij se proizvodi i koristi u vrlo malim količinama. Najveći dio proizvedenog stroncij-karbonata koristi se za pravljenje katodnih cijevi, trajnih magneta i, zbog intenzivne crvene boje plamena, kao dodatak u pirotehničkim sredstvima.[24] Metalni stroncij najviše se koristi u industriji aluminija (kao primarni i sekundarni topionik i kalup za lijevanje) i zajedno s natrijem kao mikrostrukturni materijal za legiranje aluminija i silicija uz udio silicija 7–12%. Male količine dodanog stroncija mijenjaju eutektičnu tačku legure silicija i aluminija te poboljšavaju njene mehaničke osobine. Bez dodavanja stroncija, legure aluminija i silicija gruba su i igličasta zrna, slabih mehaničkih osobina.[23] Svoje oplemenjivačke osobine zadržava u otopljenim smjesama spremnim za lijevanje duže od natrija, jer se malo teže oksidira od njega. Kad je riječ o sporostvrdnjavajućim otopinama (pijesku za lijevanje), djelomično je potisnuo natrij, koji je korišten decenijama. Kod brzog stvrdnjavanja u metalnim trajnim oblicima, naročito kod odljeva pod pritiskom, upotreba stroncija nije neophodna jer se već pri brzom stvrdnjavanju dobija fini, oplemenjeni oblik.[25]
Stroncij se dodaje ferosiliciju za reguliranje strukture ugljičnih materijala te onemogućava neravnomjerno otvrdnjavanje pri lijevanju.[23] Osim toga, može biti korišten i kao geter u elektronskim cijevima, za uklanjanje sumpora i fosfora iz čelika, te za očvršćavanje olovnih akumulatorskih ploča.[16]
Biološka uloga[uredi | uredi izvor]
Acantharea je relativno velika grupa morskih zrakastih protozoa koje grade zamršene mineralne kosture sastavljene od stroncij-sulfata.[26] U biološkim sistemima kalcij se zamjenuje malim količinama stroncija.[27] U ljudskom tijelu najveći dio stroncija odlaže se u kostima. Odnos između stroncija i kalcija u ljudskim kostima ugrubo se kreće između 1:1000 i 1:2000, što je približan odnos kao i u krvnom serumu.[28]
Ljudsko tijelo apsorbira stroncij na gotovo identičan način kao i kalcij. Zbog hemijskih sličnosti ta dva elementa, stabilni izotopi stroncija ne predstavljaju nikakvu značajnu opasnost po zdravlje ljudi. Naprotiv, određeni nivoi prirodnog stroncija mogu na neki način djelovati korisno. Određeni radioaktivni izotopi, naročito 90Sr, mogu dovesti do određenih poremećaja i bolesti kostiju, uključujući i rak kostiju. Za izražavanje radioaktivnosti djelovanjem izotopa 90Sr uvedena je posebna mjerna jedinica – stroncijeva jedinica. Nedavne in vitro studije koje je proveo Koledž za dentalne nauke u New York Cityju koristeći stroncij na osteoblastima pokazale su znatna poboljšanja u osteoblastima koji izgrađuju kost.[29]
Sva četiri stabilna izotopa stroncija ugrađuju se u ljudsko tijelo u sličnim omjerima. Međutim, stvarna distribucija izotopa znatno varira od jednog do drugog geografskog područja. Na taj način, analizirajući kosti svakog pojedinca, moguće je približno odrediti njegovo geografsko porijeklo. Ovaj pristup može pomoći u identifikaciji drevnih seoba naroda i ustanovljavanju porijekla ljudskih ostataka na arheološkim nalazištima. Odnos između količina stroncijevih izotopa može pomoći i forenzičarima.
Reference[uredi | uredi izvor]
- ^ Harry H. Binder (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- ^ Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 2009, 113, str. 5806–5812, doi:10.1021/jp8111556.
- ^ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing (2005). Lehrbuch der Experimentalphysik, vol. 6: Festkörper (2 izd.). Walter de Gruyter. str. 361. ISBN 978-3-11-017485-4.CS1 održavanje: više imena: authors list (link)
- ^ N. N. Greenwood; A. Earnshaw (1988). Chemie der Elemente (1 izd.). Weinheim: VCH. str. 136. ISBN 3-527-26169-9.CS1 održavanje: više imena: authors list (link)
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang (2011). "Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks". Journal of Chemical & Engineering Data. 56: 328–337. doi:10.1021/je1011086.CS1 održavanje: više imena: authors list (link)
- ^ Protelos and Osseor Arhivirano 3. 7. 2018. na Wayback Machine, Evropska medicinska agencija
- ^ Hans Lüschen (1968). Die Namen der Steine. Das Mineralreich im Spiegel der Sprache (2 izd.). Thun, München: Ott Verlag. str. 329, 381. ISBN 978-3-7225-6265-0.
- ^ J. F. Blumenbach: Ueber den Strontianit, ein Schottisches Fossil, das ebenfalls eine neue Grunderde zu enthalten scheint; und über einige andere naturhistorische Merkwürdigkeiten u: Johann Heinrich Voigt (ur.), Magazin für das Neueste aus der Physik und Naturgeschichte. 1891, 8, 3, str. 68–72
- ^ J. R. Partington (1942). "The early history of strontium". Annals of Science. 5 (2): 157–166. doi:10.1080/00033794200201411.
- ^ Humphry Davy: Electro-Chemical Researches, on the Decomposition of the Earths; With Observations on the Metals Obtained from the Alkaline Earths, and on the Amalgam Procured from Ammonia. u: Philosophical Transactions of the Royal Society of London. 1808, 98, str. 333–337. (sažetak).
- ^ Robert Bunsen (1855). "Darstellung des Lithiums". Justus Liebigs Annalen der Chemie. 94 (1): 107–111. doi:10.1002/jlac.18550940112.
- ^ Arnold F. Holleman, Nils Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 izd.). Berlin: de Gruyter. str. 1238. ISBN 978-3-11-017770-1.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica. 1974, B30, str. 193.
- ^ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties Arhivirano 23. 9. 2008. na Wayback Machine (PDF). u: Nuclear Physics. 2003, vol. A 729, str. 3–128.
- ^ Martin Volkmer (1996). Basiswissen Kernenergie. Bonn: Informationskreis Kernenergie. str. 30. ISBN 3-925986-09-X.
- ^ a b c Helmut Sitzmann: Strontium. Thieme Chemistry (izdavač): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 2011.
- ^ Windscale-Kernreaktorunfall. u: Römpp Chemie-Lexikon. Thieme Verlag, mart 2002.
- ^ Tschernobyl-Kernreaktorunfall. u: Römpp Chemie-Lexikon. Thieme Verlag, mart 2002.
- ^ Jozef Goldblat, David Cox (1988). Nuclear weapon tests: prohibition or limitation?. Stockholm International Peace Research Institute, Oxford University Press. str. 83-85. ISBN 978-0-19-829120-6.
- ^ David R. Lide (ur.) (2009). CRC Handbook of Chemistry and Physics (90 izd.). Boca Raton, Florida: CRC Press. ISBN 1420090844., Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea
- ^ a b Webmineral – Celestine
- ^ Webmineral – Mineral Species sorted by the element Sr (Strontium)
- ^ a b c d e f J. Paul MacMillan, Jai Won Park, Rolf Gerstenberg, Heinz Wagner, Karl Köhler, Peter Wallbrecht (2005). "Strontium and Strontium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_321.CS1 održavanje: više imena: authors list (link)
- ^ a b Marc A. Angulo: Strontium (PDF; 85 kB). U.S. Geological Survey, Mineral Commodity Summaries, januar 2010.
- ^ "Strontium". Gießereilexikon (17 izd.). Berlin: Verlag Schiele&Schön. 1997. ISBN 3-7949-0606-3.
- ^ De Deckker Patrick (2004). "On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios". Hydrobiologia. 517: 1. doi:10.1023/B:HYDR.0000027333.02017.50.
- ^ Pors Nielsen S. (2004). "The biological role of strontium". Bone. 35 (3): 583–8. doi:10.1016/j.bone.2004.04.026.
- ^ Cabrera Walter E.; et al. (1999). "Strontium and Bone". Journal of Bone and Mineral Research. 14 (5): 661–8. doi:10.1359/jbmr.1999.14.5.661. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ "The Effects of Strontium Citrate on Osteoblast Proliferation and Differentiation". Arhivirano s originala, 6. 10. 2008. Pristupljeno 7. 7. 2009.
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Stroncij |
- WebElements.com – stroncij
- Chemistry in its element podcast
- Strontium na The Periodic Table of Videos (Univerzitet u Nottinghamu)






![{\displaystyle \mathrm {^{90}_{35}Br\ {\xrightarrow[{{1,91}\ {\ s}}]{\beta ^{-}}}\ _{36}^{90}Kr\ {\xrightarrow[{{32,32}\ {\ s}}]{\beta ^{-}}}\ _{37}^{90}Rb\ {\xrightarrow[{{158}\ {\ s}}]{\beta ^{-}}}\ _{38}^{90}Sr\ {\xrightarrow[{{28,78}\ {\ a}}]{\beta ^{-}}}\ _{39}^{90}Y\ {\xrightarrow[{{64,0}\ {\ h}}]{\beta ^{-}}}\ _{40}^{90}Zr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/19f9b7b23a0458ceaaba9f31db69cbb831bf119a)



